* 물 (h>o)
* 산소 가스 (O₂)
반응 방정식은 다음과 같습니다.
2 hqo a (aq) → 2 h₂o (l) + o₂ (g)
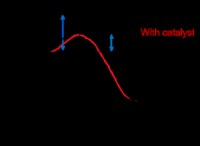
mnon는이 반응에서 촉매로 작용한다. 이것은 스스로 소비하지 않고 반응의 속도를 높이는 것을 의미합니다. 메커니즘은 mno₂가 물과 산소로의 분해를위한 표면을 제공하는 것을 포함한다.
다음은 어떤 일이 발생하는지에 대한 고장입니다.
1. h>o₂ 분자는 mno₂의 표면에 흡착된다.
2. mno₂ 촉매는 h₂o₂에서 O-O 결합의 파괴를 용이하게한다. .
3. 이로 인해 물 (HATE) 및 산소 가스 (OAT)가 형성됩니다.
4. mno₂ 촉매는 변경되지 않은 상태로 유지되며 더 많은 h₂o₂의 분해를 촉진 할 준비가되어있다. .
요약 : H₂O₂ 및 Mno₂의 반응은 물과 산소 가스를 생성하며, Mno₂는 촉매로 작용하여 h₂o₂의 분해를 가속화시킨다.