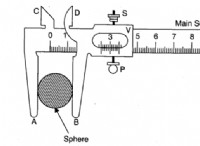
과정 :
* 전자 손실 : 금속성 요소는 가장 바깥 쪽 껍질에서 전자를 잃는 경향이있어 긍정적으로 하전됩니다. 이는 비교적 낮은 이온화 에너지로 인한 것이므로 전자를 흘리기 위해 에너지 적으로 유리하다는 것을 의미합니다.
* 양이온 형성 : 결과적으로 긍정적으로 하전 된 종을 양이온이라고합니다 . 손실 된 전자의 수는 양이온의 전하를 결정합니다. 예를 들어, 나트륨 (NA)은 하나의 전자를 잃고 NAI가되는 반면, 칼슘 (CA)은 2 개의 전자를 잃어 Ca²⁺가됩니다.
속성 변화 :
* 화학 반응성 : 금속 이온은 그들의 중성 상대보다 더 반응성이됩니다. 그들은 화학 반응에 쉽게 참여하여 비금속과 결합하여 이온 성 화합물을 생성합니다.
* 물리적 특성 : 금속 요소의 물리적 특성은 이온이 될 때 크게 변합니다.
* 전도도 : 이온 성 화합물은 일반적으로 고체 상태에서 전기 도체가 열악하지만 물에 용해되거나 녹을 때 우수한 도체입니다.
* 용융점 및 비등점 : 이들 특성은 이온들 사이의 정전기 상호 작용의 강도에 의해 영향을 받는다. 일반적으로, 이온 성 화합물은 금속성 대응 물에 비해 더 높은 용융 및 끓는점을 갖는다.
* 외관 : 금속은 종종 특징적인 광택을 가지고 있지만, 이온 형태는 무색에서 밝은 색에 이르기까지 다른 외관을 가질 수 있습니다.
예 :
* 나트륨 (NA) , 부드럽고 은빛 금속은, 하나의 전자를 쉽게 잃어 Na⁺가되어 염화나트륨 (NaCl)과 같은 이온 성 화합물을 형성합니다.
* 철 (Fe) , 강력하고 가단성 금속은 반응 조건에 따라 다수의 양이온 (Fe²⁺ 및 fe³⁺)을 형성 할 수있다. 이들 이온은 녹에서 산화철을 포함하여 많은 화합물에서 필수 성분이다.
* 알루미늄 (al) , 경량 및 다재다능한 금속은 알루미늄 산화 알루미늄 (ALAO₃)과 같은 다양한 응용 분야에서 도자기의 주요 구성 요소 인 Al³⁺ 이온을 형성합니다.
응용 프로그램 :
금속 이온의 형성은 광범위한 공정 및 기술의 기본입니다.
* 전기 화학 : 전해 용액에서 금속 이온의 움직임은 배터리, 전기 도금 및 기타 전기 화학 응용 분야에 중요합니다.
* 야금 : 금속 이온의 형성과 거동을 이해하는 것은 광석에서 금속을 추출하고이를 정제하는 데 필수적입니다.
* 생물학 : 많은 중요한 생물학적 과정은 뼈 형성, 엽록소의 마그네슘 (mg²) 및 헤모글로빈의 철 (Fe²⁺)과 같은 금속 이온에 의존합니다.
본질적으로, 금속 요소의 이온으로의 변형은 다양한 분야에서 광범위한 영향을 미치는 기본적인 화학 현상이다. 그것은 우리 주변의 세계에서 요소가 행동하고 상호 작용하는 매혹적이고 다양한 방법을 강조합니다.