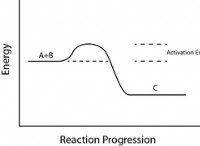
사면체 구성 :
* 혼성화 : SP3 혼성화
* 채권 수 : 4 개의 단일 채권
* 예 : 탄소 원자가 4 개의 수소 원자에 결합되는 메탄 (CH4).
* 이유 : 탄소 원자는 1 개의 2s 궤도와 3 개의 2p 궤도를 결합하여 4 개의 SP3 하이브리드 궤도를 생성합니다. 이들 하이브리드 궤도는 전자 사이의 거리를 극대화하기 위해 사면체 형태로 배향된다.
평면 구성 :
* 혼성화 : SP2 혼성화
* 채권 수 : 3 개의 시그마 본드와 1 개의 PI 본드
* 예 : 에틸렌 (C2H4), 여기서 탄소 원자는 각각 다른 탄소 원자에 이중 결합되고 2 개의 수소 원자에 단일 결합된다.
* 이유 : 탄소 원자는 1 개의 2s 궤도와 2 개의 2p 궤도를 결합하여 3 개의 SP2 하이브리드 궤도를 생성합니다. 이 궤도는 비행기에 놓여 삼각 평면 모양을 형성합니다. 나머지 2p 궤도는 평면에 수직 인 PI 결합을 형성한다.
주요 요인 :
* 전자 그룹의 수 : 탄소 원자 주위의 전자 그룹 (결합 및 고독한 쌍 포함)의 수는 혼성화를 결정합니다.
* 이중 및 트리플 본드 : 이중 및 삼중 결합은 PI 결합으로 인해 하나의 전자 그룹으로 계산됩니다.
* 고독한 쌍 : 탄소 원자의 고독 쌍은 또한 전자 그룹 수에 기여하고 구성에 영향을 미칩니다.
요약 :
* SP3 하이브리드 화 사면체로 연결됩니다 종종 단일 채권으로 구성.
* SP2 하이브리드 화 평면 로 연결됩니다 구성, 종종 이중 채권으로 구성.
분자의 모양과 특성을 예측하는 데 하이브리드 화 및 전자 구성을 이해하는 것이 중요합니다.