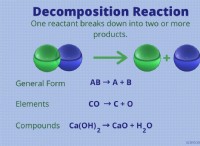
기본 이해
* 이온 성 화합물 : 양으로 하전 된 이온 (양이온)과 음의 하전 된 이온 (음이온) 사이의 정전기 인력에 의해 형성된다.
* 금속 및 비금속 : 금속은 양이온을 형성하기 위해 전자를 잃는 경향이있는 반면, 비금속은 음이온을 형성하기 위해 전자를 얻는다.
공식을 예측하는 단계
1. 양이온과 음이온을 식별하십시오 :
* 주기율표 또는 공통 이온 표를 사용하여 관련된 이온의 전하를 결정하십시오. 예를 들어:
* 나트륨 (na)은 na⁺를 형성합니다
* 염소 (CL)는 Cl⁻를 형성합니다
* 칼슘 (ca)은 ca²⁺를 형성합니다
* 산소 (O)는 o²⁻를 형성합니다
2. 요금의 균형 :
* 총 양전하는 안정적인 이온 성 화합물의 총 음전하와 동일해야합니다.
* 구역을 사용하여 전하 중립을 달성하는 데 필요한 각 이온의 수를 나타냅니다.
예
* 염화나트륨 (NaCl) :
* na> + cl⁻-> NaCl (요금 잔액)
* 산화 칼슘 (CAO) :
* Ca²⁺ + o²⁺-> Cao (충전 잔액)
* 산화 알루미늄 (Allate) :
* al³⁺ + o²⁺-> al₂o₃ (2 x +3 =3 x -2)
* 불소 마그네슘 (mgf₂) :
* mg²⁻ + f⁺-> mgf₂ (요금 잔액)
일반적인 다 원자 이온
일부 이온 성 화합물은 다 원자 이온 (전체 전하를 갖는 원자 그룹)을 함유한다. 공식을 예측하려면 그들의 요금을 알아야합니다.
예 :
* 황산 암모늄 (NH₄) ₂ SOA :
* nh₄⁺ + so₄⁺²⁻-> (nh₄) ₂so₄ (2 x +1 =1 x -2)
키 포인트
* 가장 간단한 비율 : 이온 공식은 항상 이온의 가장 간단한 전수 비율을 사용하여 작성됩니다.
* 요금 예측 : 정기적 인 트렌드를 사용하여 많은 공통 이온의 전하를 예측할 수 있습니다.
* 전이 금속 : 전이 금속은 여러 번의 충전을 가질 수 있습니다. 올바른 공식을 결정하려면 화합물 이름과 같은 추가 정보가 필요할 수 있습니다.
연습 :
이들 이온 성 화합물에 대한 공식을 예측하십시오.
* 칼륨 브로마이드
* 철 (III) 클로라이드
* 설파이드 리튬
* 인산 칼슘
이것들이나 다른 예제에 대한 도움을 원하시면 알려주세요!