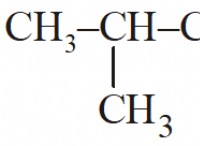1. 주석 (sn)의 몰 질량을 결정하십시오.
*주기적인 테이블에서 찾을 수 있습니다. 주석의 몰 질량은 약 118.71 g/mol입니다.
2. 몰 질량을 사용하여 그램을 두더지로 변환하십시오.
* 컵의 질량을 주석의 어금니 질량으로 나눕니다.
sn =(Sn의 질량) / (Sn의 몰 질량)의 두더지
SN =(41.7 g) / (118.71 g / mol)의 두더지
Sn ≈ 0.351 mol의 두더지
따라서 41.7g 컵에는 약 0.351 몰의 주석 원자가 있습니다.