원리 :
* 용해도 차이 : 에틸 아세테이트는 물에 상대적으로 용해되지만, 특정 염의 존재 하에서는 용해도가 크게 감소합니다. 이것은 salting-out 효과 때문입니다 .
* 수화 : 많은 무기 염은 물에 용해 될 때 그 주위에 물 분자를 강력하게 끌어 들이고 결합합니다 (수화). 이것은 에틸 아세테이트를 용해시키는 데 이용 가능한 유리수의 양을 줄입니다.
* 상 분리 : 물이 덜 사용 가능 해짐에 따라 에틸 아세테이트는 용해성이 떨어지고 수성 상으로부터 분리되는 경향이있어 상단에 뚜렷한 층이 형성됩니다.
과정 :
1. 소금 선택 : 소금을내는 데 사용되는 가장 일반적인 염은 염화나트륨 (NaCl)과 염화 칼륨 (KCl) 입니다. . 황산 마그네슘 (MGSO4) 및 염화 칼슘 (CACL2)과 같은 다른 염도 효과적이지만 다른 특성을 가질 수 있습니다.
2. 소금을 추가하십시오 : 에틸 아세테이트와 물의 혼합물에 상당한 양의 선택한 소금을 첨가하십시오. 정확한 양은 제거하려는 물의 농도에 따라 다릅니다.
3. 저어 : 혼합물을 적극적으로 저어 최대한 소금을 많이 녹입니다.
4. 분리 허용 : 혼합물이 정착되도록하십시오. 에틸 아세테이트는 염 용액 위에 별도의 층을 형성 할 것이다.
5. 별도의 층 : 분리 깔때기 또는 피펫을 사용하여 에틸 아세테이트의 상부 층을 조심스럽게 제거하십시오.
성공을위한 팁 :
* 온도 : 이 공정은 실온에서 가장 잘 작동하거나 약간 따뜻합니다.
* 포화 : 물을 포화시키기 위해 충분한 소금을 넣으십시오. 초기 양이 레이어를 완전히 분리하지 않으면 소금을 더 추가해야 할 수도 있습니다.
* 건조 : 에틸 아세테이트는 여전히 약간의 잔류 물을 함유합니다. 더 건조 시키려면 황산 마그네슘 또는 염화 칼슘과 같은 건조제를 사용할 수 있습니다.
중요한 메모 :
* 안전 : 화학 물질로 작업 할 때는 항상 적절한 안전 고글과 장갑을 착용하십시오.
* 처분 : 지역 규정에 따라 염 용액 및 과도한 에틸 아세테이트를 폐기하십시오.
대체 방법 :
소금에 절개가 효과적이지만 에틸 아세테이트에서 물을 제거하는 다른 방법은 다음과 같습니다.
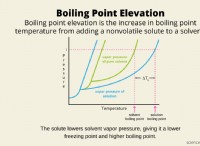
* 증류 : 이것은 끓는점에 따라 구성 요소를 분리하기 때문에 물을 제거하는보다 효율적인 방법입니다.
* 분자 체로 : 이들 다공성 물질은 물 분자를 흡수하여 에틸 아세테이트를 건조시킬 수있다.
귀하의 요구와 자원에 가장 적합한 방법을 선택하십시오.