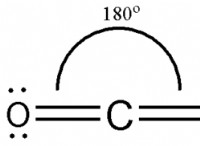
다음은 고장입니다.
주요 기능 :
* 중앙 원자 : 사면체의 중앙에는 단일 원자가 있습니다.
* 4 개의 채권 : 이 중심 원자는 다른 원자 또는 원자 그룹과 4 개의 결합을 형성합니다.
* 결합 각도 : 두 채권 사이의 각도는 약 109.5도입니다.
* 대칭 : 사면체 모양은 4 개의 동일한면을 가지고 있으며 각각은 삼각형이며 대칭입니다.
사면체 분자의 예 :
* 메탄 (CH4) : 메탄의 탄소 원자는 4 개의 수소 원자에 결합된다.
* 물 (H2O) : 물은 전체적으로 구부러진 형태를 갖는 반면, 그 중심 산소 원자는 수소 원자에 2 개의 결합을 형성하고 2 개의 고독한 전자 쌍을 형성하여 산소 주위에 사면체 배열을 초래한다.
* 암모늄 이온 (NH4+) : 질소 원자는 4 개의 수소 원자에 결합된다.
사면체 모양의 중요성 :
* 본딩 : 사면체 형상은 결합 원자 또는 원자 그룹의 최대 분리를 허용하여 전자-전자 반발을 감소시키고 안정성을 최대화합니다.
* 반응성 : 분자의 모양은 다른 분자와 상호 작용하는 방식을 지시하기 때문에 반응성에 영향을 줄 수 있습니다.
* 물리적 특성 : 사면체 분자는 종종 녹는 점, 끓는점 및 용해도와 같은 독특한 특성을 나타냅니다.
사면체 구조 식별 :
* VSEPR 이론 : 이 이론은 중앙 원자를 둘러싼 전자 쌍의 수에 기초한 분자의 형상을 예측한다. 중앙 원자 주위에 4 개의 전자 쌍이 일반적으로 사면체 형상을 초래합니다.
* 분자 모델 : 물리적 모델을 구축하면 분자에서 원자의 3 차원 배열을 시각화하는 데 도움이 될 수 있습니다.
참고 : 많은 분자가 사면체 구조를 채택하지만, 고독한 전자 쌍, 결합 길이 및 분자간 힘과 같은 요인으로 인해 예외가 있습니다.