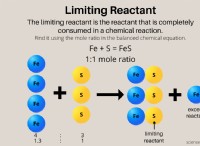
HCL (염화 수소)
* 물리적 특성 :
* 상태 : 실온에서 무색 가스는 물에 매우 용해됩니다.
* 냄새 : 매운, 짜증나는 냄새.
* 끓는점 : -85 ° C
* 용융점 : -114 ° C
* 화학적 특성 :
* 높은 산성 : 수에 용해되어 염산 (HCL (AQ)), 강산 인산을 형성합니다.
* Reacts readily with bases: 염기와 물을 형성하기 위해 기초를 중화시킵니다.
* 금속과 반응 : 많은 금속과 반응하여 수소 가스 및 금속 염화물을 생산할 수 있습니다.
h₂cl₂ (디클로린)
* 물리적 특성 :
* 상태 : 실온에서 황록색 가스.
* 냄새 : 강하고 질식하는 냄새.
* 끓는점 : -34 ° C
* 용융점 : -101 ° C
* 화학적 특성 :
* 산화제 : 매우 반응성이 높고 강한 산화제 역할을합니다.
* 물과 반응 : 물과 천천히 반응하여 염산 (HCl)과 차아 염소산 (HCLO)을 형성합니다.
* 유기 화합물과 반응 : 많은 유기 화합물과 반응하여 종종 연소 또는 치환 반응을 유발할 수 있습니다.
주요 차이점 :
1. 구성 : HCl은 하나의 수소 원자와 1 개의 염소 원자를 함유하는 반면, H₂Cll은 2 개의 수소 원자와 2 개의 염소 원자를 함유한다. 이러한 조성의 차이는 상당히 다른 결합 및 화학적 행동으로 이어진다.
2. 본딩 : HCl은 단일 공유 결합을 가지며, H₂Cl₂은 이중 공유 결합을 갖는다. H₂Cl in의 이중 결합은 더 불안정하고 반응성이 있습니다.
3. 산도 : HCl은 강한 산으로 용액 중에서 양성자 (H+)를 쉽게 기증합니다. h₂cl₂은 산성이 아니다. 산화제 역할을 할 가능성이 더 높습니다.
4. 반응성 : HCL은 금속 및 염기와 반응성이 높고, H₂Cll은 많은 유기 화합물과 극도로 반응하며 강한 산화제로서 작용한다.
요약하면, HCL 및 HALCLA는 별개의 물리적 및 화학적 특성을 갖는 완전히 다른 화학 화합물이다. 이 차이는 주로 분자 구조, 결합 및 반응성에서 비롯됩니다.