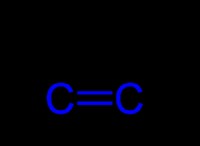
1. 결합 및 전자 구성 :
* so₂ : 이산화황은 황과 각 산소 원자 사이에 이중 결합을 갖는다. 황 원자는 이중 결합으로부터 여분의 전자를 수용하기 위해 3D 궤도를 사용하여 황과 산소 둘 다에 대한 안정적인 옥트 구성을 초래한다.
* so : 황산화물은 황과 산소 사이에 단일 결합만을 갖는다. 이것은 불완전한 옥틴으로 황 원자를 남겨 두어 반응성이 높고 불안정합니다.
2. 공명 구조 :
* so₂ : 이산화황은 공명을 나타냅니다. 이 비편성은 분자의 안정성에 기여합니다.
* so : 일산화 황은 공명 구조가 없으므로 덜 안정적입니다.
3. 열역학적 고려 사항 :
* so₂ : 황과 산소로부터의 SO₂의 형성은 발열 성이며 에너지를 방출하고 안정적인 생성물을 나타낸다.
* so : 황과 산소로부터의 SO의 형성은 덜 발열되어 덜 안정적인 생성물을 시사한다.
4. 산화 상태 :
* so₂ : SO has에서, 황은 +4의 산화 상태를 가지며, 이는 SO의 +2 산화 상태에 비해 황에 대한 더 안정적인 산화 상태이다.
5. 분자 모양 :
* so₂ : 이산화황은 구부러진 분자 모양을 가지며, 이는보다 유리한 전자 분포를 제공하고 전자 반발을 감소시킨다.
* so : 황산화물은 선형 모양을 가지며, 전자 반발 가능성으로 인해 덜 안정적이다.
요약 :
유황 이산화황의 이중 결합, 공명, 유리한 산화 상태, 발열 형성 및 구부러진 분자 형태는 일산화 황에 비해 더 큰 안정성에 기여합니다.