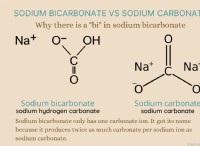
* 원자 구조 : 수소 원자는 하나의 양성자와 하나의 전자를 갖는다. 이 간단한 구조는 전류를 운반 할 수있는 자유 전자가 거의 없음을 의미합니다.
* 기체 상태 : 수소는 일반적으로 실온에서 가스입니다. 가스는 밀도가 매우 낮으므로 원자는 멀리 떨어져 있고 상호 작용할 가능성이 적습니다. 이로 인해 전자가 한 원자에서 다른 원자로 쉽게 이동하기가 어렵습니다.
* 공유 결합 : 수소 원자가 분자를 형성 할 때 (H2), 이들은 공유 결합에서 전자를 공유한다. 이 공유 전자는 분자 내에서 단단히 고정되어 있으며 전도에 쉽게 이용 가능하지 않습니다.
그러나 몇 가지 예외가 있습니다.
* 액체 수소 : 수소가 액체 형태 인 경우 기체 상태보다 더 나은 도체가됩니다. 이는 원자가 서로 가까워서 전자 이동 가능성을 높이기 때문입니다.
* 금속 수소 : 매우 높은 압력 (목성의 핵심과 같은)에서 수소는 금속 상태로 변형 될 수 있습니다. 이 금속 수소는 매우 우수한 전기 도체 인 것으로 예상됩니다.
요약 : 일반적인 가스 상태의 수소는 전기와 열의 열악한 지체입니다. 그러나 액체 또는 금속 형태에서 전도도가 크게 증가 할 수 있습니다.