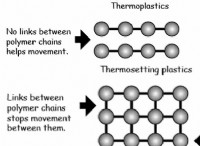
유형의 채권 탄소가 형성 될 수 있습니다 :
* 단일 결합 (C-C 또는 C-H) : 탄소는 4 개의 단일 결합을 형성하여 각 결합 원자와 하나의 전자를 공유 할 수 있습니다. 이것은 유기 화학에서 가장 일반적인 결합 패턴입니다.
* 이중 결합 (C =C 또는 C =O) : 탄소는 하나의 이중 결합을 형성하여 다른 원자와 두 개의 전자를 공유 할 수 있습니다. 이것은 단일 채권보다 더 강한 결합을 만듭니다.
* 트리플 본드 (C≡C 또는 C≡N) : 탄소는 하나의 트리플 결합을 형성하여 다른 원자와 3 개의 전자를 공유 할 수 있습니다. 이것은 가장 강력한 유형의 결합 탄소가 형성 될 수 있습니다.
공통 결합 조합 :
* 4 개의 단일 채권 :
* 메탄 (CH4) : 탄소는 4 개의 수소 원자로 4 개의 단일 결합을 형성합니다.
* 에탄 (C2H6) : 2 개의 탄소 원자는 단일 결합으로 연결되며, 각각은 수소 원자와 3 개의 단일 결합을 형성합니다.
* 두 개의 이중 결합 :
* 이산화탄소 (CO2) : 탄소는 2 개의 산소 원자로 2 개의 이중 결합을 형성합니다.
* 하나의 이중 채권과 2 개의 단일 채권 :
* ethene (C2H4) : 2 개의 탄소 원자는 이중 결합으로 연결되어 있으며, 각각은 2 개의 수소 원자와 하나의 단일 결합을 형성한다.
* 하나의 트리플 본드와 하나의 단일 본드 :
* ethyne (C2H2) : 2 개의 탄소 원자는 트리플 결합으로 연결되어 있으며, 각각은 하나의 수소 원자와 하나의 단일 결합을 형성한다.
결합 조합에 영향을 미치는 다른 요인 :
* 전기 음성 : 탄소와 본딩 파트너 간의 전기 음성 차이는 결합 유형에 영향을 미칩니다. 예를 들어, 탄소와 산소 (C =O) 사이의 결합은 산소의 전기 음성 성이 높기 때문에 극성입니다.
* 혼성화 : 탄소의 궤도 배열은 결합에 영향을 줄 수 있습니다. 상이한 혼성화 체계 (SP3, SP2, SP)는 상이한 결합 각도 및 기하학을 초래한다.
참고 : 탄소는 또한 더 큰 분자에서보다 복잡한 결합 조합을 형성 할 수있다. 예를 들어, 순환 구조, 방향족 화합물 및 분지 사슬은 모두 단일, 이중 및 삼중 결합의 다양한 조합을 포함한다.