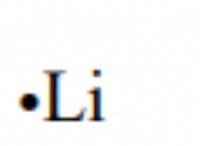* 원자가 전자 : 이들은 원자의 가장 바깥 쪽 껍질에있는 전자입니다. 그것들은 화학적 결합과 관련된 것입니다.
* 산화 상태 : 원자의 산화 상태는 화학적 결합을 형성하는 데 획득, 손실 또는 공유 된 전자의 수를 나타냅니다.
연결 :
* 금속 : 금속은 안정적인 전자 구성을 달성하기 위해 원자가 전자를 잃는 경향이 있습니다. 그들의 산화 상태는 양수이며 종종 그들이 가진 원자가 전자의 수에 해당합니다.
예를 들어, 나트륨 (NA)은 1 개의 원자가 전자를 가지며 가장 일반적인 산화 상태는 +1입니다.
* 비금속 : 비금속은 가장 바깥 쪽 쉘을 완성하기 위해 전자를 얻는 경향이 있습니다. 그들의 산화 상태는 음성이며 8에서 원자가 전자의 수를 빼서 계산할 수 있습니다.
예를 들어, 염소 (CL)는 7 개의 원자가 전자를 가지며 가장 일반적인 산화 상태는 -1입니다.
예외 :
* 전이 금속 : 이들 요소는 가변적 인 산화 상태가있다. 왜냐하면 그들은 가장 바깥 쪽과 두 번째로 (두 번째로) 껍질에서 전자를 잃을 수 있기 때문이다. 이것은 여러 가지 가능한 산화 상태로 이어집니다.
* 그룹 14 요소 : 탄소 및 실리콘과 같은 요소는 결합 환경에 따라 양성 및 음성 산화 상태를 모두 가질 수 있습니다.
요약 :
원소의 원자가 전자의 수는 대부분 산화 상태를 결정합니다. 산화 상태는 이론적 개념이며 분자의 원자에 대한 실제 전하가 아니라는 것을 기억하는 것이 중요합니다. 그러나 화학적 반응성 및 결합 형성을 이해하는 데 유용한 프레임 워크를 제공합니다.