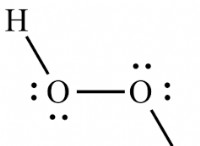
수산화 바륨에 대한 특정 pH 값을 줄 수없는 이유는 다음과 같습니다.
* 농도 문제 : 용액의 pH는 염기의 농도에 의존한다. 수산화 바륨의보다 농축 된 용액은 희석액보다 더 높은 pH (더 많은 알칼리성)를 가질 것이다.
* 용해도 한계 : 수산화 바륨은 물의 용해도가 제한적입니다. 용액의 pH는 수산화 바륨 용해의 양에 따라 다릅니다.
pH를 결정하는 방법 :
바륨 수산화물 용액의 pH를 계산하려면 다음을 알아야합니다.
1. 용액의 농도 : 이것은 일반적으로 어금니 (리터당 몰)로 제공됩니다.
2. 수산화 바륨의 용해도 : 참조 표 또는 문헌 에서이 값을 찾을 수 있습니다.
예 :
수산화 바륨의 0.1m 용액을 가지고 있으며 용해도는 3.89 g/100 ml라고 가정 해 봅시다.
1. OH 이온의 농도를 계산합니다 :
* BA (OH) (하나의 BA²⁺ 이온과 2 개의 OH 이온으로 분리됩니다.
* 따라서 0.1 m Ba (OH) ₂ 용액의 [OH ⁻]는 0.2 M입니다.
2. poh를 계산합니다 :
* poh =-log [oh⁻] =-log (0.2) =0.70
3. pH : 계산
* ph + poh =14
* pH =14-0.70 =13.30
중요한 참고 : 이 예는 완전한 해리를 가정하고 용액이 포화된다고 가정합니다. 실제로, 용해도 한계는 실제 pH에 영향을 줄 수 있습니다.
항상 수산화 바륨의 용해도 및 해리에 대한 특정 정보에 대한 신뢰할 수있는 출처와 다른 화학 물질. .