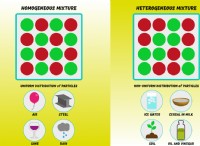
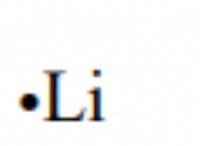1. 세력 사이의 "전쟁의 줄다리":
* 이온 결합 : 이온 성 화합물은 반대로 하전 된 이온 (양이온 및 음이온) 사이의 강한 정전기력에 의해 함께 유지된다.
* 수소 결합 : 물 분자는 극성이며, 이는 약간 양의 말단 (수소 원자 근처)과 약간 음의 말기 (산소 원자 근처)를 의미합니다. 이 극성은 물 분자가 서로 및 다른 극성 분자와 수소 결합을 형성 할 수있게한다.
2. 용해 과정 :
* 수화 : 이온 성 화합물이 물에 배치되면 물 분자는 이온을 둘러싸고 있습니다. 물 분자의 약간 양의 말단은 음이온 (음의 하전 이온)에 끌리며, 물 분자의 약간 음의 끝은 양이온 (양으로 하전 된 이온)에 끌린다.
* 명소 극복 : 이온에 대한 물 분자의 매력은 이온 성 결정 격자에서 이온을 함께 고정하는 매력을 극복 할 수있을 정도로 강해야합니다.
* 해리 : 수화 공정이 성공하면, 이온 성 화합물은 개별 이온으로 분리되어 (해리) 물 분자로 둘러싸여있다. 이 수화 된 이온은 이제 용액에서 자유롭게 움직일 수 있습니다.
용해도에 영향을 미치는 주요 요인 :
* 극성 : 물은 극성 용매이므로 비극성 화합물보다 극성 화합물 (이온 성 화합물과 같은)을 용해시킨다.
* 격자 에너지 : 결정 격자에서 이온 결합의 강도. 격자 에너지가 높을수록 화합물을 용해시키기가 더 어려워집니다.
* 수화 에너지 : 물 분자와 이온 사이의 인력의 강도. 수화 에너지가 높을수록 화합물을 용해시킬 수 있습니다.
예 :
* 염화나트륨 (NaCl) 나트륨 및 염화물 이온의 수화 에너지는 NaCl 결정을 함께 유지하는 격자 에너지보다 크기 때문에 물에 용해됩니다.
요약하면, 이온 성 화합물이 물에 용해되기 위해서는 물 분자와 이온 사이의 매력이 이온을 고체에 함께 고정하는 매력적인 힘보다 강해야합니다.