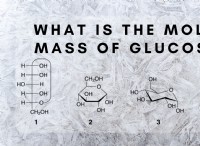
산화 수는 무엇입니까?
* 산화 수는 모든 결합이 이온 성인 경우 원자가 가질 수있는 가상 전하를 나타냅니다.
* 화학 반응에서 전자의 움직임을 추적하는 데 도움이됩니다.
* 산화 숫자는 양수, 음수 또는 0 일 수 있습니다.
산화 수 할당 규칙 :
1. 순수한 요소 : 원소 형태의 원자의 산화 수는 항상 Zero 입니다. . 예를 들어, O₂ (산소 가스)에서 각 산소 원자는 산화 수가 0입니다.
2. 모나상 이온 : 모나토미 이온의 산화 수는 전하와 같습니다. 예를 들어, Na⁺ (나트륨 이온)에서 나트륨의 산화 수는 +1입니다.
3. 수소 : 일반적으로 산화 수는 +1 입니다 화합물에서. 예외에는 수소가 산화 수가 -1 인 금속 수 소화물 (예 :NAH)이 있습니다. .
4. 산소 : 일반적으로 산화 수는 -2 입니다 화합물에서. 예외에는 과산화물 (예를 들어, h₂o₂)이 있습니다. 산소는 산화 수가 -1 의 산화 수를 갖는다. 산소가 산화 수 -1/2 인 수퍼 옥사이드 (예 :Ko₂) .
5. 불소 : 항상 -1 의 산화 수가 있습니다 화합물에서.
6. 그룹 1 (알칼리 금속) : 항상 +1 의 산화 수가 있습니다 .
7. 그룹 2 (알칼리성 지구 금속) : 항상 +2 의 산화 수가 있습니다 .
중성 화합물에서 산화 수의 합 : 중성 화합물에서 모든 원자의 산화 수의 합은 항상 Zero 입니다. .
9. 이온에서의 산화 수의 합 : 다 원자 이온에서 모든 원자의 산화 수의 합은 이온의 전하와 동일하다.
예 :
* h₂o (물)
* 산소의 산화 수는 -2입니다 (규칙 4).
* 수소의 산화 수는 +1입니다 (규칙 3).
* 화합물이 중성이므로 산화 수의 합은 0이어야합니다 :2 (+1) + (-2) =0.
* so₄²> (황산염 이온)
* 산소의 산화 수는 -2입니다 (규칙 4).
* 이온의 전반적인 전하는 -2입니다.
* 황의 산화 수를 찾기 위해 방정식을 설정합니다. x + 4 (-2) =-2, 여기서 x는 황의 산화 수입니다.
* x를 해결하면 x =+6을 얻습니다.
중요한 메모 :
* 전기 음성 : 일반적으로, 결합에서 더 전기 음성 원자는 음의 산화 수가 할당된다.
* 분수 산화 수 : 특히 복잡한 구조를 가진 화합물에서 분수 산화 수를 가질 수 있습니다.
* 연습은 완벽하게 만듭니다 : 산화 번호 계산을 마스터하는 가장 좋은 방법은 다양한 화합물 및 이온으로 연습하는 것입니다.
특정 예제를 함께 작업하고 싶다면 알려주세요. 도와 드리겠습니다!