산산 용해
* 이온화 : 산이 물에 용해 될 때, 물 분자에 양성자 (H+)를 기증하여 히드로 늄 이온 (H3O+)을 형성합니다. 이것을 이온화라고합니다.
* 평형 : 이온화 과정은 일반적으로 평형 반응으로 산이 양성자를 기증하고 받아 들일 수 있음을 의미합니다. 산의 강도는 그것이 얼마나 많은 이온화를하는지를 결정합니다.
* 증가 된 H+ 농도 : 하이드로 늄 이온의 존재는 용액에서 수소 이온 (H+)의 농도를 증가시킨다.
* 낮은 pH : H+ 이온의 증가는 pH 값이 낮아서 더 산성 용액을 나타냅니다.
예 :
염산 (HCL)은 물에 용해되는 것 :
HCl (AQ) + H2O (L) ⇌ H3O + (AQ) + Cl- (AQ)
용해베이스
* 수산화 이온 형성 : 수산화 나트륨 (NAOH)과 같은 강한 염기는 수산화물 이온 (OH-)을 형성하기 위해 물에 직접 분리됩니다.
* 양성자 수용 : 암모니아 (NH3)와 같은 약한 염기는 수 분자로부터의 양성자를 수용하여 수산화물 이온 및 이들의 접합체 산을 형성한다.
* OH- 농도 증가 : 수산화물 이온의 존재는 용액에서 수산화물 이온 (OH-)의 농도를 증가시킨다.
* 높은 pH : 옴의 증가는 pH 값이 높아져 더 기본적인 솔루션을 나타냅니다.
예 :
암모니아 (NH3) 물에 용해 :
NH3 (AQ) + H2O (L) ⇌ NH4 + (AQ) + OH- (AQ)
키 포인트
* 강도 : 산 또는 염기의 강도는 용액에서 얼마나 많은 이온화를하는지를 결정합니다. 강산/염기는 완전히 이온화되는 반면, 약산/염기는 부분적으로 이온화됩니다.
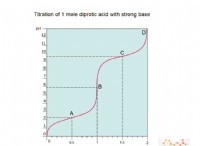
* pH 스케일 : pH 척도는 용액의 산도 또는 염기성을 측정합니다. 7의 pH는 중성이고, 7 미만은 산성이며, 7 이상은 기본입니다.
* 화학 반응 : 산과 염기는 중화 반응에서 서로 반응하여 물과 소금을 형성 할 수 있습니다.
특정 산이나 염기에 대해 더 자세한 내용을 원하시면 알려주세요!