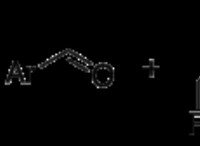
* 산은 양성자 공여자입니다 : 그들은 용액에서 수소 이온 (H+)을 방출한다.
* 비금속은 일반적으로 전기 음성입니다 : 그들은 전자를 잃지 않고 전자를 얻는 경향이 있습니다.
이것은 비금속이 산으로부터 양성자 (H+)를 받아들이지 않을 가능성이 없다는 것을 의미합니다.
예외 :
이 일반 규칙에는 몇 가지 예외가 있으며, 일부 비금속은 특정 조건 하에서 특정 산과 반응 할 수 있습니다.
* 할로겐 (f, cl, br, i) : 염소 및 브롬과 같은 일부 할로겐은 농축 질산 (HNO₃) 또는 농축 황산 (HASSOA)과 같은 강한 산화 산과 반응 할 수 있습니다. 이 반응은 종종 할로겐 산화물 또는 할라이드를 생성합니다. 예를 들어:
* cl₂ + hno₃ → nocl + clo₂ + h₂o (질산과 반응하는 염소)
* 탄소 : 탄소는 뜨거운 농축 황산과 반응하여 이산화탄소를 생산할 수있다 (CO₂).
주목하는 것이 중요합니다 :
* 비금속과의 산 반응은 종종 복잡하며 특정 조건이 필요합니다.
* 많은 비금속은 산이 아닌 염기와 반응 할 가능성이 높습니다.
요약 :
예외가 있지만, 비금속은 일반적으로 전자를 얻는 경향이 있고 양성자를 수용 할 가능성이 없기 때문에 일반적으로 산과 반응하지 않습니다.