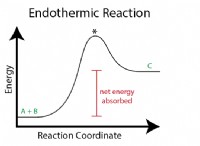
1. 온도 :
* 온도 증가 : 분자에 더 많은 에너지를 제공하여 운동 에너지와 충돌 빈도를 증가시킵니다. 이는 더 성공적인 충돌과 더 빠른 반응 속도로 이어집니다.
2. 농도 :
* 반응물의 농도 증가 : 농도가 높을수록 주어진 부피에 반응물 분자가 더 많아서 더 빈번한 충돌과 더 빠른 반응 속도가 있습니다.
3. 표면적 :
* 표면적 증가 : 고체를 포함하는 반응의 경우, 표면적 증가 (예를 들어, 더 작은 입자로 고체를 연삭함으로써)는 더 많은 반응물 분자가 접촉하여 반응을 가속화시킨다.
4. 촉매 : * 촉매의 존재 : 촉매는 반응의 활성화 에너지를 낮추어 에너지 장벽이 낮은 대안 경로를 제공한다. 이를 통해 반응이 같은 온도에서 더 빨리 진행될 수 있습니다.
5. 압력 (기체 반응의 경우) :
* 압력 증가 : 기체 반응의 경우, 압력을 증가 시키면 반응물의 농도가 증가하여 충돌이 더 자주 발생하고 반응 속도가 빠릅니다.
6. 빛 :
* 빛의 존재 : 일부 반응은 빛, 특히 광화학 반응에 의해 시작되거나 가속화됩니다.
7. 반응물의 특성 :
* 화학적 특성 : 일부 분자는 구조와 결합으로 인해 다른 분자보다 본질적으로 더 반응성입니다.
요약 :
* 에너지 : 시스템의 에너지 (온도)를 증가 시키면 더 활기차고 빈번한 충돌이 발생합니다.
* 충돌 주파수 : 충돌 수 (농도, 표면적, 압력)를 증가 시키면 충돌의 성공 가능성이 높아집니다.
* 활성화 에너지 : 활성화 에너지 (촉매)를 낮추면 더 많은 분자가 에너지 장벽을 극복하여 더 빠른 반응을 일으킨다.
이러한 요소가 서로 상호 작용할 수 있으며 반응 속도에 대한 특정 영향이 복잡 할 수 있음을 기억하는 것이 중요합니다.