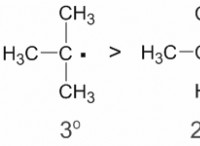
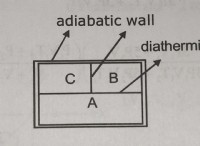
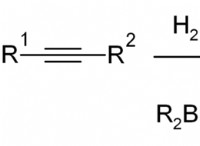다음은 예외와 함께 이것이 종종 그렇습니다.
용융 및 끓는점이 낮은 이유 :
* 약한 분자간 힘 : 유기 화합물은 주로 반 데르 발스 세력 (런던 분산 힘, 쌍극자 쌍극자 상호 작용 및 수소 결합)에 의존하여 분자를 함께 유지합니다. 이 힘은 일반적으로 많은 무기 화합물에서 발견되는 이온 성 및 공유 결합보다 약합니다. 약한 분자간 힘은 극복하기 위해 에너지가 적어 용융점과 비등점이 낮아집니다.
* 더 작은 분자 크기 : 많은 유기 분자는 상대적으로 작으며 분자간 상호 작용을위한 표면적이 적습니다. 이는 이러한 상호 작용의 강도를 더욱 감소시키고 용융점 및 비등점을 낮추는 데 기여합니다.
예외 :
* 큰 유기 분자 : 중합체와 같은 더 큰 유기 분자는 높은 용융 및 끓는점을 가질 수 있습니다. 이는 큰 크기와 체인 간의 다중 분자간 상호 작용의 존재가 이러한 힘을 극복하는 데 필요한 에너지를 크게 증가시키기 때문입니다.
* 강한 분자간 상호 작용을 가진 화합물 : 알코올 및 카르 복실 산과 같은 강한 수소 결합을 형성하는 유기 화합물은 유기 성질에도 불구하고 비교적 높은 용융 및 끓는점을 가질 수 있습니다.
* 방향족 화합물 : 벤젠과 같은 방향족 화합물은 분자간 상호 작용을 향상시키는 비편성 전자 시스템으로 인해 비교적 높은 용융 및 끓는점을 가지게됩니다.
* 결정질 유기 고체 : 특정 유기 분자는 강한 분자간 힘으로 결정질 구조를 형성하여 더 높은 융점을 초래할 수 있습니다.
요약 :
많은 유기 화합물은 약한 분자간 힘과 더 작은 분자 크기로 인해 용융 및 끓는점이 낮지 만 많은 예외가 있습니다. 유기 화합물의 용융 및 끓는점은 분자 크기, 분자간 힘의 성질 및 기능적 그룹의 존재를 포함한 복잡한 인자의 상호 작용에 의존한다.