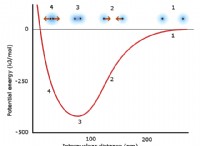
1. 구성 요소를보십시오 :
* 금속 및 비금속 : 이온 성 화합물은 전형적으로 금속 양이온 (양으로 하전 된 이온)과 비금속 음이온 (음의 하전 이온) 사이의 정전기 인력에 의해 형성된다.
* 예 : 염화나트륨 (NaCl) - 나트륨 (NA)은 금속이고 염소 (CL)는 비금속입니다.
2. 요금을 고려하십시오 :
* 양이온 및 음이온 : 이온 성 화합물은 항상 순 중립 전하를 갖는다. 이는 금속 양이온의 양전하가 비금속 음이온의 음전하의 균형을 맞추어야한다는 것을 의미합니다.
* 예 : 염화나트륨에서, 나트륨은 +1 이온 (Na +)을 형성하고 염소는 -1 이온 (Cl-)을 형성한다. 요금은 완벽하게 균형을 이룹니다.
3. 일반적인 다 원자 이온을 확인하십시오 :
* 원자 그룹 : 일부 이온 성 화합물은 다 원자 이온을 함유하며, 이는 전하를 갖는 단일 단위로서 작용하는 원자 그룹이다.
* 예 : 수산화 나트륨 (NAOH)은 -1 전하를 갖는 다 원자 성 수산화물 이온 (OH-)을 함유한다.
4. 물리적 특성을 고려하십시오 :
* 높은 용융 및 끓는점 : 이온 성 화합물은 이온 사이에 강한 정전기 인력을 가지므로 높은 용융 및 끓는점을 초래합니다.
* 실온에서 고체 : 대부분의 이온 성 화합물은 강한 힘으로 인해 실온에서 고체입니다.
* 용해되거나 녹을 때 전기를 전도하십시오 : 물에 용해되거나 녹을 때 이온 성 화합물은 이온이 자유롭게 움직일 수 있기 때문에 전기를 전도 할 수 있습니다.
5. 화학 공식 사용 :
* 이진 화합물 : 이진 이온 성 화합물 (금속 및 비금속)의 공식은 일반적으로 단순한 패턴을 따릅니다. 금속 양이온이 먼저 나열되고 비금속 음이온이 두 번째로 나열됩니다.
* 다 원소 화합물 : 다 원자 이온을 갖는 화합물의 공식은 종종 다수성 이온 주변의 괄호를 포함하여 다중성을 나타낸다.
이온 성 화합물의 예 :
* 염화나트륨 (NaCl)
* 칼륨 브로마이드 (KBR)
* 산화 칼슘 (CAO)
* 황산 마그네슘 (MGSO4)
* 염화 암모늄 (NH4CL)
참고 : 이 규칙에는 몇 가지 예외가 있지만 이온 성 화합물을 식별하기위한 좋은 출발점 역할을 할 수 있습니다.