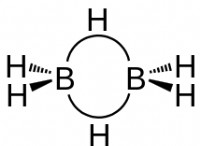
* 이성질체 둘 이상의 화합물이 동일한 분자 공식을 갖지만 원자의 구조적 배열을 갖는 현상이다.
* 이온 성 화합물 반대로 하전 된 이온 사이의 정전기 인력에 의해 형성된다. 결정 격자에서 이온의 배열은 분자 내의 원자의 특정 배열이 아니라 이온의 전하 및 크기에 의해 결정된다.
이온 성 화합물과 공유 화합물 사이의 주요 차이 :
* 공유 화합물 원자 사이에 전자를 공유함으로써 형성된다. 이들 공유 전자의 배열은 분자의 구조와 특성을 결정하여 이성질체의 가능성을 초래한다.
* 이온 성 화합물 한 원자에서 다른 원자로 전자를 전달함으로써 형성되어 이온이 형성된다. 이온 성 화합물의 구조는 이들 이온들 사이의 정전기 상호 작용에 의해 결정된다.
예 :
공식 NaCl (염화나트륨)으로 화합물을 고려해 봅시다. 종이에 NA와 CL 원자를 어떻게 정리하는지는 중요하지 않습니다. 고체 상태에서는 항상 반복되는 입방 격자 구조를 형성합니다. 이 구조는 분자 내의 원자의 특정 배열에 의해 이온 상호 작용에 의해 결정된다.
요약 : 이온 성 화합물은 그들의 구조가 분자 내의 원자의 특정 배열이 아니라 정전기력에 의해 결정되기 때문에 이성질체를 나타내지 않는다.