붕소 에탄, 붕소 수 소화물 및 디보론 헥사 하이드 라이드의 이름으로도 알려진 디보 레인은 화학적으로 B2H6으로 표시됩니다. 디보 레인은 붕소 화합물 패밀리의 주요 멤버입니다. 디보 레인의 몰 질량은 27.66 그램/몰스이며, 이는 디보 레인 (B2H6)에 존재하는 모든 구성 요소의 합입니다.
디보 레인의 결합
이름에서 알 수 있듯이, 디보 레인은 붕소의 2 개의 원자의 화합물이며,이 2 개의 붕소 원자와 함께 6 개의 수소 원자가 존재한다. 우리가 알다시피, 붕소의 원자 수는 5이고 전자 구성은 1S2, 2S22P1로 작성되며, 구성에서 붕소 3 개의 원자가 전자가 존재한다는 것을 알 수 있습니다. 이 3 개의 원자가 전자는 수소와의 결합 형성에 참여합니다.
각 붕소 원자의 3 개의 원자가 전자 중에서, 2 개의 전자는 공유 결합의 형성의 결과로 전자를 공유함으로써 2 개의 수소 원자와 결합을 만듭니다. 이 유형의 결합은 2 개의 센터 -2 전자 결합으로 알려져 있습니다. 이 공유 결합의 형성은 분자 궤도 이론에 의해 정당화된다. 두 수소 원자는 분자의 말단 끝에 존재하는 말단 수소라고합니다.
붕소의 남은 전자는 3 개의 중심이 붕소 - 하이드로 겐 - 보론 인 3 개의 중심 - 전자 결합으로 하나의 수소와 교량 결합을 만듭니다. 이 본드에는 두 개의 전자가 관여합니다. 이 다리 본드는 바나나 본드로도 알려져 있습니다. 구조는 바나나처럼 구조적 이며이 본드의 특성은 이온 성질을 보여줍니다.
.디보 레인 구조에서 말단 수소와 붕소 원자 사이의 결합 길이는 1.19Å입니다. 디보 레인의 구조에서 브리지 수소와 붕소 원자 사이의 결합 길이는 1.33Å이다. 말단 붕소 수소 결합의 길이는 브리지 붕소 수소 결합보다 작으므로 더 큰 강도를 나타냅니다.
적외선 스펙트럼의 주파수 값은 브리지 붕소 수소 결합과 더 비교됩니다. 더 강한 결합은 더 많은 에너지로 진동하며 높은 진동 주파수를 나타냅니다. 따라서 말단 붕소 수소의 주파수는 브리지 붕소 수소 결합 이상의 것입니다. 브리지 붕소 - 하이드로겐 결합 및 말단 붕소 - 하이드로 겐 결합의 주파수 값은 각각 2100 및 2500 cm -1입니다.
디보 레인의 구조
위의 결합에 대한 위의 설명에서 디보 레인의 구조는 다음과 같이 표시됩니다. 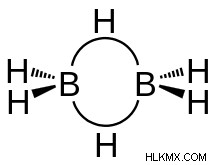
디보 레인의 구조에서, 각 붕소 원자는 SP3 혼성화에 존재하며, 이는 붕소 원자가 4 개의 하이브리드 궤도를 갖는데, 이는 결합의 형성에 참여한다는 것을 의미한다. 이 4 개의 하이브리드 궤도 중에서, 3 개의 궤도만이 전자를 운반하여 결합을 만들 수 있습니다. 두 개의 하이브리드 궤도는 붕소 - 하이드로겐 결합을 만들고 하나의 하이브리드 궤도는 붕소 - 하이드로겐 브리지 본드를 만듭니다. 이 4 개의 하이브리드 궤도 중에서, 하이브리드 궤도 중 하나는 비어 있으며 교량 수소와의 다른 바나나 결합의 형성에 참여한다.
디포 란의 구조는 4 개의 말단 하이드로겐과 2 개의 붕소 원자가 하나의 평면에 존재하고 브리지 수소가 수직 평면으로 그 평면 위와 아래에 존재함에 따라 비평선이다. 이 디보란 분자는 D2H 포인트 그룹 대칭의 범주에 속하며, 이는 디보 레인의 구조가 정체성 작동, 대칭 중심을 통한 역전 및 붕소 원자와 수소 원자 사이의 3 개의 시그마 결합을 따라 3 개의 C2 회전 축으로 구성되어 있음을 의미합니다.
.결론
디보 레인 분자는 화학의 다른 유기 분자에 비해 다소 다릅니다. 디포 란 분자는 4 개의 터미널 정상 B – H 공유 결합에 추가하여 브리지 결합으로서 2 개의 b – h -b 바나나 결합으로 구성되기 때문입니다. 다이보 란의 구조는 교량 수소가 아래 및 다른 평면 위에 존재함에 따라 비 임금입니다.