이온 성 화합물 이해
이온 성 화합물은 금속 (일반적으로 주기성 테이블의 왼쪽으로부터)이 전자 (양으로 하전 된 양이온이되는)를 잃고 비금속 (일반적으로 주기성 테이블의 오른쪽으로부터)을 잃을 때 형성됩니다. 이 반대로 하전 된 이온은 서로를 정전기 적으로 끌어내어 강한 결합을 형성합니다.
이온 성 화합물 식별
1. 요소를보십시오 :
* 금속 + 비 금속 : 화합물이 금속과 비금속을 함유하면 이온 성일 가능성이 높습니다.
* 예 :NaCl (염화나트륨) - 나트륨 (NA)은 금속이고 염소 (CL)는 비금속입니다.
2. 다 원자 이온을 확인하십시오 :
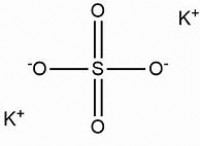
* 다 원자 이온 : 이들은 전하를 갖는 단일 단위 역할을하는 원자 그룹이다. 일반적인 예는 다음과 같습니다.
* 질산염 (No₃⁻) , 설페이트 (so₄²⁻) , 인산염 (po₄³⁻) , 수산화물 (OH태) , 암모늄 (nh₄⁺)
* 다 원자 이온을 갖는 이온 성 화합물 : 화합물에 다 원자 이온이 포함 된 경우, 일반적으로 이온 성입니다.
* 예 :Ca (NOIT) ₂ (질산 칼슘) - 칼슘 (CA)은 금속이며 질산염 (NOA)은 다 원자 이온입니다.
3. 전기 음성을 고려하십시오 :
* 전기 음성 : 이것은 전자를 유치하는 원자가의 능력의 척도입니다. 비금속은 금속보다 전기 음성이 높습니다.
* 큰 전기 음성 차이 : 이온 결합은 원소들 사이에 상당한 전기 음성 차이가있을 때 형성됩니다.
* 주기율표 또는 온라인 리소스에서 전기 음성 값을 찾을 수 있습니다.
4. 물리적 특성 :
* 높은 용융 및 끓는점 : 이온 성 화합물은 이온 결합이 강하기 때문에 높은 용융 및 끓는점을 갖는 경향이 있습니다.
* 실온에서 고체 : 대부분의 이온 성 화합물은 실온에서 고체입니다.
* 용해되거나 녹을 때 전기를 전도하십시오 : 이온 성 화합물은 이온이 자유롭게 움직일 때 물에 용해되거나 녹을 때 전기를 전도합니다.
예 :
* 이온 : NaCl (염화나트륨), K₂O (산화 칼륨), 카코 (탄산 칼슘)
* 이온이 아님 : Co₂ (이산화탄소), H₂O (물), ch₄ (메탄) - 이들 화합물은 공유 (전자 공유)입니다.
키 포인트 :
* 모든 금속 비 금속 화합물이 이온 성인 것은 아닙니다. 일부는 공유 결합 (예를 들어, 일산화탄소, CO)을 형성 할 수 있습니다.
* 전기 음성 차이는 유용한 지표가 될 수 있지만 항상 결정적인 규칙은 아닙니다.
확실하지 않은 경우 자세한 내용은 신뢰할 수있는 화학 교과서 나 웹 사이트를 참조하는 것이 가장 좋습니다.