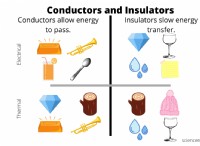
* 산도는 H+ 이온의 존재에 의해 결정됩니다. 산은 물에 용해 될 때 수소 이온 (H+)을 방출합니다. 이것은 산의 정의 특성입니다.
* 금속은 일반적으로 H+ 이온을 방출하지 않습니다 : 대부분의 금속은 물에 용해 될 때 수소 이온을 쉽게 기증하지 않습니다. 실제로, 많은 금속은 산과 반응하여 수소 가스를 방출합니다.
* 예외가 존재합니다 : 알루미늄 및 아연과 같은 일부 금속은 물 또는 특정 산과 반응하여 금속 수산화물을 형성하고 수소 이온을 방출 할 수 있습니다. 이것은 특정 상황에서 산처럼 행동하게 만듭니다.
* 솔루션은 복잡합니다. 견고한 용액의 거동, 특히 두 금속이 포함 된 거동은 복잡 할 수 있습니다. 혼합물의 특성은 개별 금속과 크게 다를 수 있습니다.
특정 고체 용액이 산성인지 확인하려면 다음을 고려해야합니다.
1. 관련된 금속 : 그들은 산성 화합물을 형성하거나 물/산과 반응하여 H+ 이온을 생성하는 것으로 알려져 있습니까?
2. 조건 : 물, 기타 물질 및 온도의 존재는 모두 고체 용액의 거동에 영향을 줄 수 있습니다.
요약하면, 두 금속을 포함하는 모든 고체 용액의 산도에 대해 일반화하는 것은 부정확합니다. 특정 금속과 그들이있는 상태는 산성 또는 기본 특성을 결정합니다.