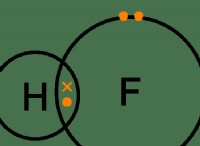
다음은 왜 공유 화합물이 이성질체를 나타내는 이유와 방법에 대한 분석입니다.
* 공유 결합 : 공유 화합물에서, 원자는 전자를 공유하여 분자를 함께 유지하는 강한 결합을 형성합니다. 그러나 이러한 채권은 다른 방식으로 배열 될 수 있습니다.
* 구조 이성질체 : 이들은 동일한 분자식이지만 원자의 다른 연결성을 가진 이성질체이다. 예를 들어, 부탄 (C4H10)은 2 개의 구조적 이성질체의 N- 부탄 및 이소 부탄을 갖는다.
* 기하학적 이성질체 : 이들은 동일한 분자식 및 원자의 연결성을 갖는 이성질체이지만 이중 결합 또는 고리 주위의 제한된 회전으로 인해 다른 공간 배열이다. 예를 들어, 시스-및 트랜스 -2- 부틴은 기하학적 이성질체이다.
* 광학 이성질체 (거울상 이성질체) : 이들은 서로의 거울 이미지이며 겹쳐질 수없는 이성질체입니다. 분자가 키랄 중심, 일반적으로 4 개의 다른 그룹에 결합 된 탄소 원자를 함유 할 때 발생합니다.
공유 화합물에서 이성질체에 기여하는 주요 요인 :
* 다중 결합 : 이중 및 삼중 결합은 회전을 제한하여 기하 이성질체를 허용합니다.
* 분기 : 탄소 사슬 내에서 원자의 상이한 배열은 구조 이성질체를 초래한다.
* chirality : 키랄 중심의 존재는 광학 이성질체로 이어진다.
공유 화합물에서 이성질체의 예 :
* 알칸 : 알칸에서 분지는 구조 이성질체 (예를 들어, 부탄, 펜탄)로 이어진다.
* Alkenes : 이중 결합의 존재는 기하학적 이성질체 (예를 들어, 시스-및 트랜스 -2- 부틴)로 이어진다.
* 탄수화물 : 포도당과 과당은 기능 그룹의 다른 배열을 갖는 구조적 이성질체이다.
요약하면, 공유 결합의 유연성과 다른 방식으로 원자를 배열하는 능력은 동일한 분자 공식이지만 다른 구조와 특성을 갖는 화합물을 생성하여 이성질체를 유발합니다. .