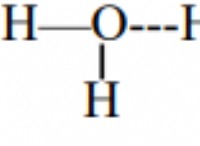이유는 다음과 같습니다.
* 수소 (H 2 ) 매우 약한 분자간 힘 (런던 분산 힘)을 갖는 규정형 가스입니다. 이 약한 힘은 쉽게 극복되어 -252.87 ° C의 끓는점이 낮습니다.
* 불소 (f 2 ) 또한 규정형 가스이지만, 분자간 력이 더 강합니다 (런던 분산 힘과 쌍극자 쌍극자 상호 작용). 이 강한 힘은 극복하기 위해 더 많은 에너지가 필요하므로 더 높은 비등점은 -188.11 ° C입니다.
따라서, 실온에서 가스 임에도 불구하고, 불소는 분자간 력이 더 강해져 끓는점이 상당히 높다.