핵심 개념
이 유기농 화학 자습서에서는 구조, 반응, 몇 가지 빠른 사실 및 주목할만한 예를 포함한 Alkynes에 대해 배우게됩니다.
Alkynes의 구조
화학자들은 "알키 (Alkyne)"라는 용어를 사용하여 탄소 탄수화 삼중 결합이있는 유기 화합물을 참조합니다. 탄화수소 에서이 트리플 본드는 주요 기능 그룹 역할을합니다. 이 트리플 결합은 하나의 반응성 시그마 결합과 2 개의 반응성 PI 결합을 갖는다.
Alkynes는 일반적인 rcξcr의 공식을 가지고 있습니다. ' 그것들은 두 개의 전자 도메인, 트리플 본드 및 각각의 가변 그룹 만 있기 때문에, 알키의 탄수화물에는 sp 가 있습니다. 이종 교잡. Ethyne은 가장 간단한 알킨 구조를 가지고 있으며 공식 hcξch :
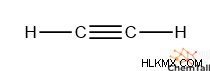
Alkenes에 대한 빠른 사실
- 구조 :다른 탄소에 결합 된 탄소 트리플.
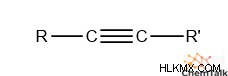
- 일반 공식 :c n h 2n-2 , 여기서 n ≥ 2
- 산도 :알켄과 알칸보다 산성이 더 많습니다
- 용해도 :물에 불용성이지만 디 에틸 에테르와 같은 비극성 유기 용매에 가용성
- CξC 결합 길이 :1.21 Å
- cξc 결합 엔탈피 :812 kJ mol-1
- IR 분광법 :알킨 트리플 결합 (CξC)은 단일 보조 또는 비정치에 따라 2140-2260 cm에서 피크를 형성합니다. c sp -말기 알켄의 채권은 3267-3333 cm에서 피크를 형성합니다.
터미널 Alkynes
수소가 알킨 기능 그룹에 부착되면 화학자들은 결과 그룹을“말단 알키 네”라고 부릅니다. 그러한 그룹은 탄화수소 끝에 위치하기 때문입니다. 이 다양한 알켄은 결합 된 수소가 현저하게 산성이기 때문에 특별합니다.
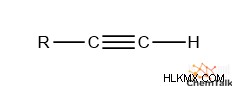
일반적으로, 탄소에 결합 된 수소는 C-H 결합의 강도로 인해 매우 낮은 산도를 갖는 경향이있다. 카르 보닐에 인접한 탄산 카본에 결합 된 수소와 같은 몇 가지 예외가 있으며, 이는 알돌 축합에 중요합니다. 말기 알킨 하이드로겐은 높은 s 로 인해이 추세를 깨뜨립니다. sp 의 특성 C-H 결합.
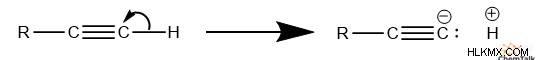
이러한 산도로 인해, 말기 알킨의 수소는 충분히 강한 염기와 상호 작용할 때 분리된다. 그런 다음 말기 알킨은 후속 반응에서 친핵체 역할을 할 수있는 카바 니온이된다.
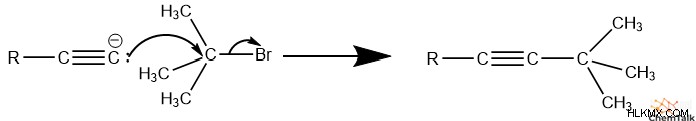
Alkynes의 예
Alkynes는 Alkenes와 동등한 친숙한 이름 지정 컨벤션을 따릅니다. 알킨과 다른 기능 그룹이없는 탄화수소의 경우, 화합물의 이름은 알키 네스 위치의 가장 낮은 수의 탄소 일 것입니다. 그 뒤에 화합물의 탄소 수를 나타내는 접두사 (eth-, prop-, but- 등), 마지막으로 접미사 -yne.
.예를 들어, 단일 말단 알킨이있는 탄화수소간에 처음 10 개의 화합물 이름은 다음과 같습니다.
- ethyne
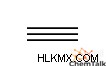
- propyne
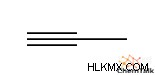
- 1- 부티네
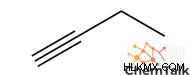
- 1-Pentyne
- 1-Hexyne
- 1-heptyne
- 1-octyne
- 1-Nonyne

- 1-decyne
- 1-undecyne
다른 기능 그룹과 더 복잡한 명명법이있는 화합물의 경우, 알키네스는 알켄 등가물과 동일한 규칙을 따릅니다.
보시다시피, 많은 알켄 분자는 안정적인 알킨 등가물을 가지고 있습니다. 이에 대한 예외는 사이클로 알켄입니다.“cycloalkynes”는 정상적으로 선형 CξC 결합의 견딜 수없는 고리 변형으로 인해 형성되는만큼 빠르게 분해되는 경향이 있기 때문입니다.
.
Alkynes와의 반응
알키네스는 삼중 결합보다는 탄소-탄소 이중 결합을 포함하는 알켄과 유사하게 행동한다. 말기 알키네스의 산도 외에도, 알킨은 본질적으로 이중 알켄처럼 행동하며, 같은 탄수화물 쌍에서 2 개의 반응성 PI 결합이 있습니다.
Alkynes와의 추가 반응
알켄과 마찬가지로, 특정 뉴 클레오 파일-전기성 화합물은 각각의 알킨 PI 결합에 걸쳐 첨가 반응을 수행 할 수있다. 예를 들어, Alkyne과 HCL 사이의 추가 반응을 살펴 보겠습니다.
이 예에서는 Propyne을 사용해 보겠습니다. 먼저, HCl은 알킨을 양성하여 PI 전자 쌍 중 하나를 사용하여 C-H 결합을 형성한다. 생성 된 분자는 비닐 양이온이며, 이는 화학자들이 알켄 탄소에 양전하를 갖는 양이온을 설명하는 데 사용하는 용어입니다. 대부분의 탄수화물과 마찬가지로, 비닐 탄수화물은 1 차 탄소 (C1)가 아닌 2 차 탄소 (C2)에 양전하를 두는 것을 선호합니다. 이 경우“2 차”는 하나의 비수소 성과 만 결합 된“1 차”탄소와 달리 2 개의 비-하이드로겐에 결합 된 탄소를 설명합니다.
둘째, 클로라이드 음이온은 탄수화물을 공격하여 알켄 할라이드 분자를 형성합니다.
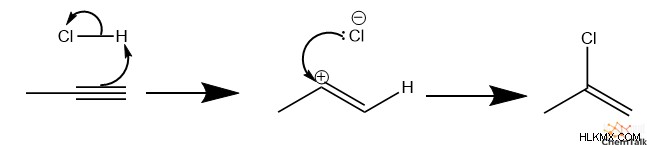
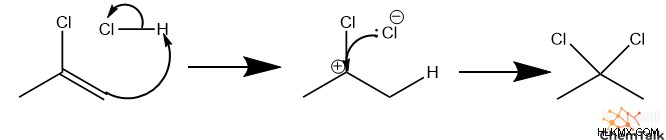
프로필 분자는 여전히 PI 결합을 가지기 때문에, 과량의 HCl에서 더 반응 할 것이다. 셋째, 또 다른 HCL은 알켄을 양성하여 C2에 탄수화물을 형성한다. 이 경우, 탄수화물은 클로라이드의 전자 흡수 효과에 의해 더 안정화된다. 마지막으로, 두 번째 클로라이드는 탄수화물을 공격하여 2,2- 디클로로 프로판을 형성합니다.
알키네의 수화
위의 메커니즘은 대부분의 알킨 첨가 반응에 적용되지만 몇 가지 예외가 있습니다. 가장 중요한 예외는 알킨에 물을 첨가하는 것입니다. Propyne을 사용하여 메커니즘을 살펴 보겠습니다.
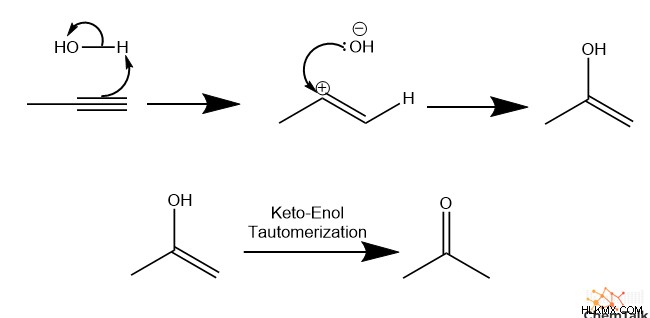
먼저, HCL과 마찬가지로, 첫 번째 PI 결합은 양성자 화되고 결과 수산화물은 2 차 비닐 탄수화물을 공격한다. 결과 화합물은 화학자들이 에놀이라고 부르는 것입니다. 알코올 탄소에 알코올이 결합되어 있습니다. 에놀 분자는 안정성이 거의없는 경향이 있습니다. 둘째, 두 번째 첨가물을 수행하기보다는 케톤을 형성하는 케토 에놀 타우토머 화를 겪습니다.
알키네스를 사용한 오 제 분해
알켄과 유사하게, 오존은 수성 조건 하에서 카르 복실 산을 형성하는 오 제 분해를 통해 알킨과 반응 할 수있다. 터미널 알키 네스가 오 제 분해를 수행 할 수 없으므로 이번에는 2-pentyne과 함께 메커니즘을 살펴 보겠습니다.
먼저, 오존은 알키 네에서 전자의 벤젠과 유사한 순환 운동을 포함하는 사이클로 첨가를 수행한다. 이것은 순환 오조 나이드 화합물을 형성합니다. 둘째, 전자의 또 다른 순환 운동이 발생하여 고리 구조를 파괴하여 이온 성 카르 보닐 산화물 그룹을 형성합니다.
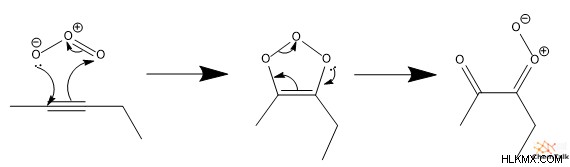
셋째, 카르 보닐 옥사이드는 수성 환경으로부터의 물과 반응하여 결국 2 개의 카르 복실 산 분자를 산출한다. 흥미롭게도, 보시다시피, 오 제 분해는 탄소-탄소 트리플 본드를 완전히 절단합니다.
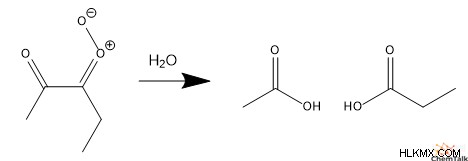
합성에서, 알킨은 카르 복실 산보다 합성 다 기능성을 갖기 때문에, 오 제 분해는 거의 사용되지 않는 경향이있다. 그러나, 화학자들은 생성 된 카르 복실 산 단편을 분석하여 알려지지 않은 알킨을 분석하기 위해 오 제 분해를 사용한다.