반응 :
* 브롬은 염소보다 더 강한 산화제입니다. 이것은 전자를 얻는 경향이 더 크다는 것을 의미합니다.
* 염화나트륨은 가용성 염입니다. 물에 용해되어 나트륨 이온 (Na+) 및 클로라이드 이온 (Cl-)을 형성합니다.
문제 :
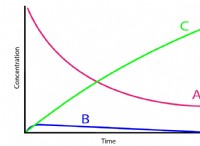
브롬과 염화나트륨 사이의 반응은 평형 반응 이다. , 한 방향으로 완성되지 않음을 의미합니다. 단순화 된 방정식은 다음과 같습니다.
2NABR (aq) + Cl2 (g) ⇌ 2NaCl (aq) + br2 (l)
* 물에서 반응은 클로라이드 나트륨 (NaCl)의 형성을 선호 할 것이다. 염소는 브로민보다 더 나은 산화제이며 일부 브로마이드 이온을 대체하기 때문입니다.
* 그러나 반응은 가역적입니다. 브롬의 일부는 용액에 남아 있으며 일부 브로마이드 나트륨이 여전히 존재합니다.
반응에 영향을 미치는 요인 :
* 농도 : 더 높은 농도의 염화나트륨 또는 염소는 염화나트륨의 형성을 향한 반응을 유도합니다.
* 온도 : 증가하는 온도는 일반적으로 덜 안정적인 종이기 때문에 브롬의 형성을 선호합니다.
요약 :
브롬은 염화나트륨과 반응 할 수 있지만, 완전한 변위 반응은 아닙니다. 반응은 염화나트륨의 형성을 선호하는 평형이지만 일부 브롬은 항상 용액에 남아 있습니다.