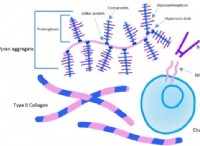
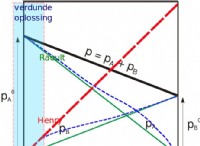
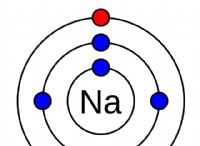
1. 용액을 산성화 :
* 많은 산화 환원 반응은 pH 의존적입니다. h₂so₂는 적합한 산성 환경을 제공합니다 적정 반응이 효율적이고 정확하게 진행되는 경우.
*이 산도는 종종 부작용을 예방하거나 원하는 산화 감소 경로를 촉진하기 때문에 중요합니다.
2. 안정적인 매체 제공 :
* 황산은 강한 산 입니다 솔루션에서 안정적으로 남아 있습니다. 이 안정성은 적정적 농도가 적정 전반에 걸쳐 일관성을 유지하여 오류를 방지하도록 보장합니다.
3. 반응 촉진 :
* h asoSo act는 촉매로 작용할 수 있습니다 일부 산화 환원 반응에서 반응 속도를 높이고 적정을 더 빨리 만듭니다.
예 :
* 과망간산염 적정 : 칼륨 과망간산염 (kmno₄)을 갖는 적정에서, mno₄⁻가 mn²⁺로 감소되기 위해 필요한 산성 조건을 유지하는 데 H ₂소 ₄가 필수적이다.
* 요오드/티오 설페이트 적정 : 요오드 (IA) 및 티오 설페이트 나트륨 (Na₂s₂o₃)을 포함하는 적정에서 HASSO₄는 반응에 필요한 산성 환경을 유지하는 데 도움이됩니다.
왜 산화제 또는 감소기로서 h notoas가 아닌가?
많은 산화 환원 적정의 성공에 hialso cruc가 중요하지만, 1 차 산화제 또는 감속기 자체는 거의 없습니다. 이것은 다음과 같습니다.
* 충분한 산화제 또는 환원제가 아닙니다. hoSo₂의 산화 환원 전위는 많은 적정에 적합한 선택으로 충분히 높지 않습니다.
* 일부 적정과 반응 할 수 있습니다. hoso₂는 반응이 적목과 직접 반응하면 반응을 방해 할 수 있습니다.
결론 :
h₂oas는 산화 감소 적정에서 귀중한 시약이며, 주로 산화제 및 안정적인 배지로서 작용한다. . 적절한 반응 조건을 보장하고 적정의 정확도를 향상시킵니다. 그러나, 산화 환원 적정에서 일차 산화제 또는 감소기로서 일반적으로 사용되지는 않습니다.