Henry의 법칙은 가스의 부분 압력과 용액에서 그 가스의 농도 사이의 수학적 관계입니다. 법에 따르면 용액에 용해되는 가스의 양은 그 가스의 부분 압력에 비례합니다.
수학에 대한 방정식이 매우 건조하고 평범한 것으로 판명 될 수 있다는 것은 사실입니다. 그들은 때때로 이러한 개념과 방정식이 실제 세계와 어떤 종류의 상관 관계를 상실한다는 높은 수준의 추상적 사고로 이어질 수 있습니다. 이것은 매우 추상적이기 때문에 Henry의 법칙에 특히 해당됩니다. 그러나 '법'이라고 불리는 이유가 있습니다. 즉, 가장 과학적이고 수학적으로 정확한 방식으로 자연의 현상을 설명하기 때문입니다. 이제 Henry의 법칙에 대한 기본적인 이해를 확립 해 보겠습니다.
이론적 이해
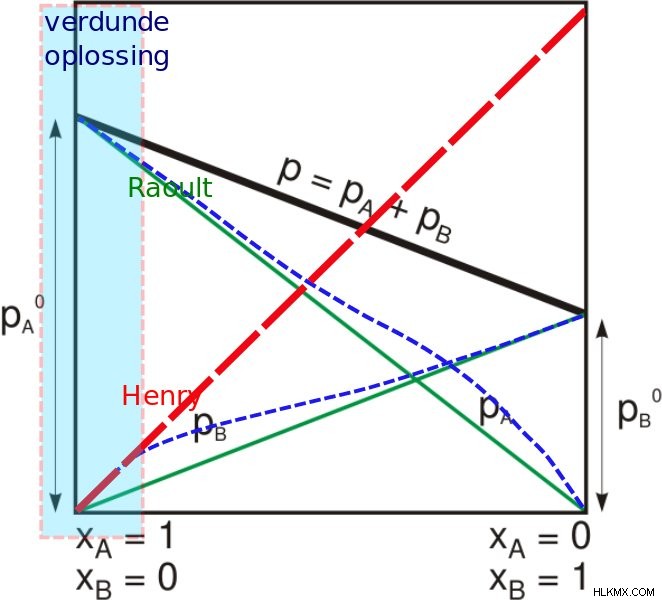
(사진 크레딧 :JCWF/Wikimedia Commons)
가스가 액체의 표면과 접촉 할 때, 용액에 들어갈 가스의 양은 해당 가스의 부분 압력에 비례합니다. 분석을 위해 약간의 가스와 액체가 물이라고 가정 해 봅시다. 특정 온도에서 용해되는 가스의 양은 가스가 액체에 가하는 부분 압력에 따라 다릅니다. 우리가 기억해야 할 간단한 점은 용해 된 가스와 용해되지 않은 가스가 평형 상태라는 것입니다. Henry의 법칙에 대한 간단한 근거는 가스의 부분 압력이 평균적으로 두 배나 높으면 기체 분자 수의 두 배가 물 표면에 부딪칩니다. 가스 혼합물의 경우 Henry의 법칙은 용액으로 들어갈 가스의 양 (또는 여러 수의 가스)을 예측하는 데 도움이되지만 가스가 다른 가스가 다른 용해도 수준을 가지므로 속도에도 영향을 미칩니다.
방정식
이제 우리는 Henry의 법칙에 대한 단일 광범위한 적용을 이해 했으므로 Henry의 법칙에 대한 이해에보다 엄격한 수학적 접근을하겠습니다. 가스와 액체는 평형 관계에 도달합니다.
액체> 가스
cshe =pi
다른 요소는 다음과 같은 약어로 상징됩니다.
CS =포화 농도
그는 헨리의 법률 계수
pi =가스의 부분 압력
Henry의 법률 계수 (HE)의 표준 단위는 ATM⋅m3/Mole로 표현됩니다. P는 ATM의 관점에서, 포화 함량의 경우 CS는 두더지/m3에있다. 더 큰 Henry의 법률 계수 일수록 변동성이 커지고 용해도가 줄어 듭니다. 희석 된 용액 및 비 반응 가스에 거의 주변 압력 및 온도에서 유효합니다. 이온 강도는 Henry의 계수를 증가시키고 가스 용해도를 감소시킵니다.
물의 용해 된 산소와 평형
우리는 매우 실용적인 예를 고려하여 위에서 언급 한 방정식의 실제 세계와의 물리적 관계를 이해할 수 있습니다. 물에 산소를 용해시키는 특정 사례를 봅시다. 이제 용해 된 산소는 주로 두 가지 이유로 존재했습니다. 첫 번째 이유는 그것이 수생 식물의 광합성의 부산물이기 때문입니다. 두 번째는 대기에서 직접 흡수를 통한 것입니다.
물의 산소 농도가 대기와 평형 상태에있는 경우, 농도는 Henry의 법칙에 따라 계산 될 수 있습니다. O2의 평형 상수는 769.23입니다. 물에서 산소의 평형 상수는 0.00027입니다. 이것은 물 표면에서만 평형 상수입니다. 공기/물 인터페이스 아래의 물은 반드시 대기에서 산소와 평형을 이루지 않으며 지시 된 것과 다른 평형 상수를 함유 할 수 있습니다. 호수와 바다 표면의 산소 농도가 더 큰 깊이보다 높다는 것은 알려진 사실입니다. 산소/물 관계에 대해 알아야 할 중요한 것은 백분율 포화 입니다. . 포화율은 1 리터의 물이 그 온도에서 물이 유지할 수있는 총 산소의 총량에 비해 1 리터의 물이 유지할 수있는 산소의 양입니다.
.얕은 개울의 흐르는 물은 공기와 잘 섞일 수 있기 때문에 여전히 물보다 더 나은 산소가 더 우수합니다. 온도와 산소 농도 사이에는 강한 의존성이 있습니다. 대기압은 더 높은 고도에서 낮으므로 더 높은 고도에서의 물은 해수면의 물보다 용존 산소가 적습니다. 광합성 유기체가 산소를 생산할 때와 같이, 용존 산소의 양은 낮 동안 가장 높습니다. 물의 온도가 상승함에 따라 산소를 그 자체로 용해시키는 능력이 더욱 어려워집니다. 이것은 특히 낮에는 또는 더운 여름날에 산소 수준을 낮추기 쉽기 때문에 수생 동물에게는 특히 위험 할 수 있습니다. 물의 이산화탄소 포화 및 인간 혈류의 산소 계산과 같은 Henry의 법칙의 다른 응용이 있습니다. Henry의 법칙은 가장 추상적 인 개념조차도 가장 기본적인 실제 응용 프로그램을 가지고 있음을 증명합니다.