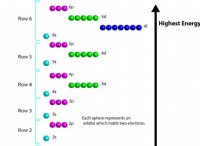
* 원자가 전자 : 이들은 원자의 가장 바깥 쪽 껍질에있는 전자입니다. 그것들은 화학적 결합과 관련된 것입니다.
* 전자 구성 : 이것은 원자의 에너지 수준과 서브 쉘에서 전자의 배열을 설명합니다.
원자가 전자를 찾고 기호를 식별하는 방법은 다음과 같습니다.
1. 전자 구성을 결정하십시오 : 주기율표에서 요소의 전자 구성을 찾거나주기적인 추세를 사용하여 찾을 수 있습니다. 예를 들어, 산소 (O)의 전자 구성은 1S²2S²2p⁴입니다.
2. 가장 바깥 쪽 쉘을 식별하십시오 : 가장 바깥 쪽 껍질은 가장 높은 주요 양자 수 (n)를 가진 껍질입니다. 산소의 경우, 가장 바깥 쪽 쉘은 n =2입니다.
3. 가장 바깥 쪽 껍질의 전자를 계산하십시오 : 이들은 원자가 전자입니다. 산소는 6 개의 원자가 전자 (2s 서브 쉘에서 2 개, 2P 서브 쉘에서 4 개)를 가지고 있습니다.
이제 몇 가지 예를 고려해 봅시다.
* 그룹 1 (알칼리 금속) : Li, NA, K, RB, CS, Fr. 이 모든 요소에는 가장 바깥 쪽 쉘에 1 개의 원자가 전자가 있습니다 (S¹).
* 그룹 2 (알칼리성 지구 금속) : BE, MG, CA, SR, BA, RA. 이 요소에는 2 개의 원자가 전자 (S²)가 있습니다.
* 그룹 17 (할로겐) : f, cl, br, i, at. 이 요소에는 7 개의 원자가 전자 (S²P⁵)가 있습니다.
* 그룹 18 (고귀한 가스) : 그는 NE, AR, KR, XE, RN. 이 요소는 가장 바깥 쪽 껍질을 갖고 있으며 매우 안정적으로 간주됩니다.
따라서 동일한 원자가 전자의 기호 세트를 찾으려면 주기율표에서 동일한 그룹 (수직 열)에 속하는 요소를 찾아야합니다.
예 :
* li, na, k 모두 1 개의 원자가 전자가 있습니다.
* be, mg, ca 모두 2 개의 원자가 전자가 있습니다.
관심있는 기호 세트를 제공하여 동일한 수의 원자가 전자를 가지고 있는지 알려줄 수 있습니다.