다음은 고장입니다.
* 발열 반응 : 이들은 일반적으로 열처럼 주변으로 에너지를 방출합니다. 불타는 나무 나 모닥불을 생각해보십시오 - 열과 빛은 방출 된 에너지입니다.
* 자발적 반응 : 이러한 반응은 제품 형성을 선호합니다. 제품은 반응물보다 낮은 에너지 상태에 있습니다. 이것은 시작하기 위해 추가 에너지가 필요하지 않고 반응이 발생할 수 있음을 의미합니다.
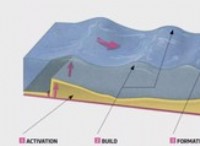
* 활성화 에너지 : 반응이 자발적이지만 여전히 시작하려면 일정량의 에너지가 필요합니다. 이것을 활성화 에너지라고합니다. 언덕 위로 바위를 밀어내는 것처럼 생각하십시오. 바위는 스스로 움직이지 않지만 (활성화 에너지) 밀기를 주면 언덕을 굴릴 것입니다 (자발적 반응).
여기에 비유가 있습니다 :
언덕에 앉아있는 공을 상상해보십시오. 공은 잠재적 인 에너지의 높은 지점에 있습니다. 공을 놓으면 언덕을 굴릴 것입니다. 이것은 자발적인 반응에 대한 비유입니다. 공은 에너지 상태가 낮기 때문에 자발적으로 내리막 길을 굴립니다.
고려해야 할 사항 :
* 반응 속도 : 반응이 자발적이지만 활성화 에너지가 높으면 매우 느리게 발생할 수 있습니다. 그렇기 때문에 나무가 타는 나무가 발열적이고 자발적이지만 나무가 실온에서 자발적으로 연소되지 않는 이유입니다.
* 평형 : 대부분의 반응은 완성되지 않습니다. 이들은 전방 반응의 속도 (생성물에 대한 반응물)가 역 반응의 속도 (반응물에 대한 생성물)와 동일하는 평형 상태에 도달한다.
결론 :
발열 반응은 종종 자발적이지만 활성화 에너지의 개념과 그것이 반응 속도에 어떤 영향을 미치는지 이해하는 것이 중요합니다. 자발적 반응은 열역학적으로 유리하지만 여전히 시작하려면 푸시가 필요할 수 있습니다.