핵심 개념
이 튜토리얼에서는주기적인 테이블의 Chalcogens 제품군과 독특한 특성에 대해 배울 것입니다.
다른 기사에서 다루는 주제
- 전자 궤도 및 궤도 형태
- 원자가 본드 이론
- 엔트로피가 무엇입니까
이온화 에너지
- 원자 반경 동향
주기율표의 chalcogens
chalcogens는 주기율표에서 그룹 16에 속하는 요소입니다. chalcogens로 분류 할 수있는 5 가지 요소, 즉 산소, 황, 셀레늄, 텔루 리움 및 폴로늄이 있습니다. 일부 과학자들은 Livermorium을 chalcogens의 일원이라고 생각합니다. 때로는 산소가 칼코겐 패밀리에서 제외되는 것이 일반적입니다. 이것은 산소의 특성이 가족의 다른 요소들 사이에서 약간 다르기 때문입니다.
칼코겐 패밀리의 각 요소는 원자가 쉘에 6 개의 전자가 있습니다. 이 요소 제품군은 그리스어 단어 "chalcos"에서 이름을 유래 한 것은 각 요소가 구리 광석과 황화물 및 산화물에서 발견되기 때문에 광석 형성을 의미합니다. 대부분의 칼 코겐은 하나 이상의 동종 요소를 가지고 있으며, 화학 요소가 둘 이상의 형태로 존재합니다. 예를 들어 황은 20 개가 넘는 동종 트로프를 가지며 산소는 약 9가있는 것으로 알려져 있습니다.
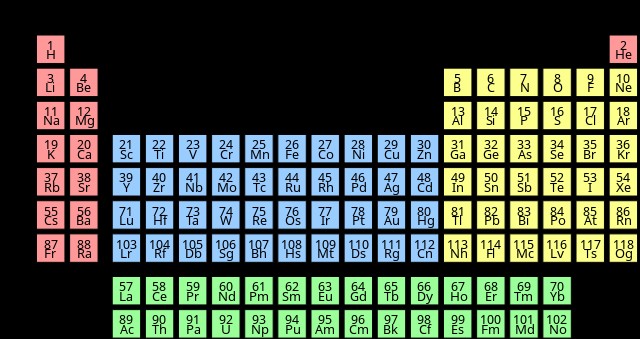
chalcogens의 전자 구성
일반적으로 칼 코겐에 대한 전자 구성은 NSNP입니다. 차트에 표시되지 않은 Livermorium의 전자 구성은 [RN] 5F6D7S7p.
입니다. | Chalcogen | 전자 구성 |
| 폴로늄 (PO) | [xe] 4f5d6s6p |
| 황 (s) | [NE] 3S3P |
| 셀레늄 (SE) | [ar] 3d4s4p |
| Tellurium (TE) | [KR] 4D5S5p |
| 산소 (O) | [그는] 2S2P |
그룹 16 요소의 원자 및 이온 반경
칼코겐 패밀리의 원소의 원자 및 이온 반경은 그룹 15 (그룹 15)의 그룹의 원소보다 작습니다. 이는 효과적인 핵 전하가 증가함에 따라 전자의 전자의 인력이 원자의 핵을 감소하기 때문입니다. 예상 한 바와 같이, 주기율표의 원자 및 이온 반경 경향에 기초하여, 우리가 그룹을 아래로 이동할 때 chalcogens의 반경이 증가합니다. 따라서, 가장 작은 원자 반경과 이온 반경을 가진 칼 코겐은 산소입니다. 가장 큰 원자 및 이온 반경을 가진 칼 코겐은 폴로늄입니다.
용융 및 끓는점
주기 테이블의 그룹을 아래로 이동할 때 원자 크기와 질량이 증가하기 때문에 이러한 요소의 용융 및 비등점은 직접적인 상관 관계를 갖습니다. 우리가 그룹을 내려 가면서 반 데르 발스 힘의 크기도 증가하기 때문입니다. 따라서 산소는 녹는 점과 끓는점이 가장 낮은 것으로 알려져 있습니다.
이온화 에너지
원자의 반경 또는 크기가 증가하면 이온화 에너지가 감소합니다. 이는 원자가 껍질의 전자가 핵에서 멀어 질수록 핵이 이들 전자에 가지고있는 인력의 힘이 적기 때문이다. 따라서 크기가 작은 원소는 종종 크기가 큰 요소보다 이온화 에너지가 더 높습니다. 이로 인해 우리가 그룹에서 내려 가면서 찰코겐의 이온화 에너지가 감소합니다. 산소는 가족 중에서 가장 높은 이온화 에너지를 갖는 것으로 알려져 있습니다. 또한주기적인 표 이온화 에너지가 증가하는 기간을 가로 질러 움직일 때 주목하는 것이 중요 할 수 있습니다. 따라서 산소는 리튬과 같은 요소보다 이온화 에너지가 더 높습니다.
그룹 16 요소 간의 반응
칼 코겐이 디 하이드로 겐과 반응 할 때 (H 2 ), 그들은 일반적으로 공식 h 2 와 함께 수 소화물을 형성합니다. X. X는 산소, 황, 셀레늄, 텔루 리움 또는 폴로늄을 나타냅니다.
x (chalcogen) + h 2 (dihydrogen) → H 2 X (chalcogen의 수 문자)
그룹 16
의 특성 산소
- 구성 :1S2S2P
- 산소는 산화를 통해 녹에서 작동하며 다른 원자와 반응하는 것으로 잘 알려져 있습니다.
- 산소는 0.00143 g/cm의 밀도를 가진 모든 칼 코겐에서 가장 밀도가 가장 낮습니다.
- 실온에서 산소는 기체 상태에 있으며 무색, 무취이며 맛이 없습니다.
- 그것은 약 -297.31도 f
폴로늄
- 폴로늄은 껍질에 2, 8, 18, 32, 18 및 6 개의 전자를 가진 모든 칼코겐 중 가장 큰 것입니다.
- 그 구성 IS 1S2SP3SPD4SPDF5SPD6SP.
입니다 - 폴로늄은 밀도가 가장 높으며 밀도는 9.196 g/cm입니다.
- 폴로늄은 끓는점이 1764도에서 텔 루륨보다 낮기 때문에 원자 무게로 증가하는 끓는점의 규칙에 대한 예외입니다.
- 33이 요소의 다른 동위 원소는 지구에서 찾을 수 있습니다.
텔루 리움
- 전자 구성 Tellurium의 경우 1S2SP3SPD4SPD5SP.
입니다 - Tellurium은 1810 도의 모든 chalcogens에서 가장 높은 끓는점을 가지고 있습니다.
- 그것은 결정적인 형태 일 때 자연적으로은 메타 로이드로 발견됩니다.
셀레늄
- 셀레늄의 전자 구성 IS 1S2SP3SPD4SP.
- 셀레늄은 비금속이지만 전기를 전도 할 수 있습니다.
- 셀레늄의 끓는점도 1265도에서 매우 높습니다.
- 자연적으로 붉은 가루로 발견되지만 처리되면 검은 색으로 변합니다.
- 셀레늄은 광전자이므로 빛에 노출 될 때 전기적으로 충전됩니다.
황
- 전자 구성 유황의 1S2Sp3sp.
입니다 - 황은 -2에서 +6 범위의 산화 상태가 넓습니다.
- 이 요소는 지각과 인체의 흔적으로 발견됩니다.
- 유황은 노란 고체이며 화상을 입을 때 썩은 냄새를냅니다.