이유는 다음과 같습니다.
* 이온 성 화합물 : 이들 화합물은 양으로 하전 된 이온 (양이온)과 음의 하전 이온 (음이온) 사이의 정전기 인력에 의해 형성된다. 이 강력한 매력은 이온이 구체적이고 반복되는 패턴으로 배열되는 단단한 결정 구조의 형성으로 이어진다.
* 반복 패턴 : 이온 성 고체에서 이온의 배열은 각각의 이온이 반대 전하의 이온으로 둘러싸여 정전기 반발을 최소화하고 인력을 극대화하도록 보장한다. 이것은 안정적인 3 차원 격자 구조를 만듭니다.
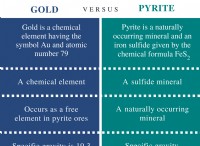
이온 성 화합물의 예 :
* 염화나트륨 (NaCl) : Na+ 양이온 및 클래 음이온으로 구성된 테이블 소금.
* 산화 칼슘 (CAO) : CA2+ 양이온 및 O2 음이온으로 구성된 시멘트 생산에 사용되는 백색 고체.
* 황산 마그네슘 (MGSO4) : MG2+ 양이온 및 SO42- 음이온으로 구성된 비료와 같은 다양한 응용 분야에 사용되는 화합물.
참고 : 이온 성 화합물을 공유 화합물과 구별하는 것이 중요합니다. 공유 화합물은 이온 사이의 정전기 인력이 아니라 전자 공유를 통해 고체를 형성합니다.