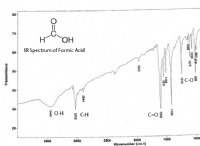
* 산과의 반응 :
* 알루미늄은 염산 (ALCL3) 및 수소 가스 (H2)를 형성하기 위해 염산 (HCL)과 같은 산과 반응합니다. 알루미늄 원자는 전자를 잃고 양으로 하전 된 이온 (AL3+)이되어 염화 이온 (Cl-)과 결합하여 염을 형성합니다.
* 방정식 : 2AL (S) + 6HCL (AQ) → 2ALCL3 (AQ) + 3H2 (g)
* 염기와의 반응 :
* 알루미늄은 또한 수산화 나트륨 (NAOH)과 같은 강한 염기와 반응하여 나트륨 알루미 네이트 (Naalo2) 및 수소 가스를 형성합니다. 이 반응은 알루미늄이 루이스 산으로 작용할 수 있고 염기의 수산화 이온 (OH-)의 전자 쌍을 받아 들일 수 있기 때문에 발생합니다.
* 방정식 : 2AL (S) + 2NAOH (AQ) + 6H2O (L) → 2Naalo2 (AQ) + 3H2 (g)
양서류 특성 :
알루미늄이 산과 염기와 반응하는 능력은 그것을 수륙 양용으로 만듭니다. 이 독특한 특성은 표면에 산화 알루미늄 (AL2O3)이 존재하기 때문입니다. 산화 알루미늄은 금속의 보호 층으로 작용하는 매우 안정적인 화합물입니다. 그러나, 산 및 염기와 반응 할 수 있으며, 산 또는 염기와의 반응은 산화물 층을 제거하여 금속이 추가로 반응 할 수있게한다.
다른 양서류 금속의 예 :
* 아연 (Zn)
* 주석 (SN)
* 리드 (PB)
* 베릴륨 (be)
결론 :
알루미늄은 산 및 염기와 반응하는 능력, 보호 산화 층의 거동과 관련된 특징 및 루이스 산 및베이스로 작용하는 능력으로 인해 양서류 금속으로 분류됩니다.