* 염화은 (Agcl) : 이것은 전형적인 예입니다. 은 이온 (Ag+) 및 클로라이드 이온 (Cl-)은 모두 용액에 존재하지만, 서로에게 매우 강한 인력을 가지며, 격렬한 격자 구조를 형성합니다. 이온들 사이의 매력은 이온과 물 분자 사이의 인력보다 강해서 매우 낮은 용해도를 초래한다.
* 황산 바륨 (Baso4) : 이 화합물은 또한 매우 불용성입니다. AGCL과 유사하게, 바륨 이온 (BA2+)과 황산염 이온 (SO42-) 사이의 강한 인력은 물에 쉽게 용해되는 것을 방지합니다.
* 탄산 칼슘 (CACO3) : 석회암과 조개 껍질에서 발견 된이 화합물은 물의 용해도가 제한적입니다. 칼슘 이온 (CA2+) 및 탄산염 이온 (CO32-)은 안정적인 격자 구조를 형성하여 물 분자가이를 분리하기가 어렵습니다.
* 납 (II) 황화물 (PBS) : 이것은 물에 본질적으로 불용성 인 검은 고체입니다. 납 이온 (PB2+)과 황화물 이온 (S2-) 사이의 강한 인력은 용해되는 것을 방지합니다.
중요한 참고 : 용해도는 흑백 개념이 아닙니다. 가장 "불용성"화합물조차도 매우 작지만 어느 정도의 용해도를 가지고 있습니다.
이온 성 화합물의 용해도는 몇 가지 요인에 달려 있습니다.
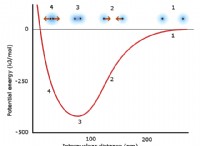
* 격자 에너지 : 고체에서 이온들 사이의 매력의 강도.
* 수화 에너지 : 이온과 물 분자 사이의 매력.
* 온도 : 용해도는 일반적으로 온도에 따라 증가합니다.
용해도에 영향을 미치는 요소에 대해 더 많이 배우고 싶다면 알려주십시오!