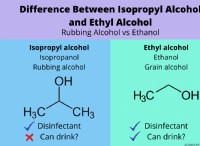
* kw =[H+] [OH-] =1.0 x 10^-14 25 ° C에서
[OH-] 를 계산하는 방법은 다음과 같습니다 :
1. [OH-] 를 해결하기 위해 KW 방정식을 재정렬하십시오 :
[OH-] =KW / [H+]
2. 주어진 [h+] 를 연결하십시오 :
[OH-] =(1.0 x 10^-14) / (4.5 x 10^-7)
3. 결과를 계산합니다 :
[OH-] =2.2 x 10^-8 m
따라서, 4.5 x 10^-7 m의 수소 이온 농도를 갖는 용액의 수산화물 이온 농도는 2.2 x 10^-8 m이다.