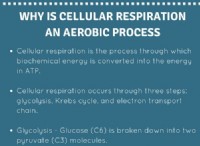
엔트로피가 증가합니다.
이유는 다음과 같습니다.
* 고체 상태 : 고체 상태에서, 요오드 분자는 고도로 정렬 된 배열로 밀접하게 포장된다. 분자는 운동의 자유가 제한되어 있습니다.
* 기체 상태 : 기체 상태에서, 요오드 분자는 널리 이격되어 있으며 운동의 자유가 훨씬 더 크다 (번역, 회전, 진동). 이러한 증가 된 운동의 자유는 더 높은 장애로 해석되며, 이는 엔트로피와 직접 관련이 있습니다.
따라서, 시스템의 엔트로피는 요오드의 승화 동안 증가한다. 이것은 고체에서 액체로 또는 액체로의 위상 변화에 대한 일반적인 관찰입니다.
추가 포인트 :
* 엔트로피는 시스템에서 장애 또는 무작위성의 척도입니다.
* 장애를 증가시키는 과정은 일반적으로 엔트로피를 증가시킵니다.
* 위상 변화가 더 정렬 된 상태에서 덜 순서가 낮은 상태 (고체 -> 액체 -> 가스)로 변경됩니다. 일반적으로 엔트로피가 증가합니다.