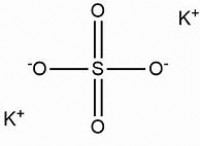
이온 결합 반대로 하전 된 이온 사이의 정전기 인력에 의해 형성된다. 이들 결합은 한 원자에서 다른 원자로 전자를 완전히 전달하는 것을 포함하여 이온이라는 전하 종의 형성을 초래한다. 이온 사이의 강한 정전기력은 극성 용매의 높은 용해도뿐만 아니라 높은 용융 및 끓는점을 초래합니다.
수소 결합 이온 결합보다 약합니다. 이들은 고도로 전기 음성 원자 (예 :산소, 질소 또는 불소)에 공유 결합 된 수소 원자와 인접 분자의 전자 쌍 사이의 인력에 의해 형성된다. 수소 결합은 높은 끓는점과 많은 물질을 용해시키는 능력을 포함하여 물의 많은 중요한 특성을 담당합니다.
강점 비교 :
* 이온 결합 강도 : 일반적으로 100-1000 kJ/mol 범위에서
* 수소 결합 강도 : 일반적으로 5-40 kJ/mol 범위에서
주요 차이점 :
* 채권의 본질 : 이온 결합은 완전한 전자 전달을 포함하는 반면, 수소 결합은 전자 쌍의 공유를 포함한다.
* 강도 : 이온 결합은 수소 결합보다 훨씬 강합니다.
* 용융 및 끓는점 : 이온 성 화합물은 수소 결합을 갖는 화합물보다 용융 및 끓는점이 더 높다.
* 용해도 : 이온 성 화합물은 일반적으로 극성 용매에 용해되는 반면, 수소 결합을 갖는 화합물은 극성 및 비극성 용매 모두에 용해 될 수있다.
결론 :
관여하는 더 강한 정전기력으로 인해, 이온 결합은 수소 결합보다 유의하게 더 강하다.