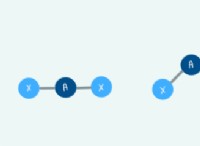
극성 용매 :
* 전자 밀도의 고르지 않은 분포가 있습니다. 이것은 분자의 한쪽 끝에 부분 양전하를 생성하고 다른쪽에는 부분적 음전하를 만듭니다.
* 예 : 물 (HATER), 에탄올 (ChaCh₂oH), 아세톤 (Ch₃coch₃) 및 메탄올 (ch₃oh).
극성 용매에 용해되는 물질 :
* 또한 극성 결합 또는 전자 밀도의 고르지 않은 분포가 있습니다.
* 예 :
* 이온 성 화합물 : 이들은 반대로 하전 된 이온 (테이블 소금, NaCl) 사이의 정전기력에 의해 함께 유지된다.
* 극성 분자 : 이들은 원자 (설탕, c₁₂h₂₂o₁₁) 사이의 전기 음성의 차이로 인해 극성 결합을 갖는다.
* 극 기능 그룹을 가진 일부 유기 분자 : 예로는 알코올, 알데히드, 케톤 및 카르 복실 산이 있습니다.
작동하는 이유 :
극성 용매 분자의 양의 끝은 극성 용질 분자의 음성 끝에 끌릴 것이며, 그 반대도 마찬가지입니다. 이 매력은 용질 분자를 함께 유지하는 힘을 극복하여 용해시킬 수 있도록 도와줍니다.
예를 살펴 보겠습니다 :
물에 테이블 소금 (NaCl)을 첨가하면 양의 나트륨 이온 (Na⁺)이 물 분자의 음의 산소 끝에 끌린다. 음성 클로라이드 이온 (CL⁻)은 물 분자의 양성 수소 끝에 끌린다. 이 상호 작용은 소금이 용해시키는 데 도움이됩니다.
대조적으로, 오일과 같은 비극성 용매는 극성 물질을 용해시키지 않습니다. 그들은 지방과 기름과 같은 비극성 물질을 용해시킵니다.