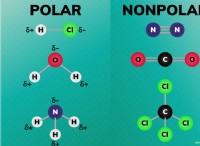
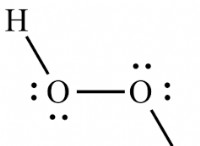
1. 루이스 구조 (도트 다이어그램) :
* 표현 : 도트를 사용하여 원자 주위의 원자가 전자를 나타내며, 전자를 공유하여 공유 결합을 형성하는 방법을 보여줍니다.
* 강점 : 이해하고 그리기 쉬운 전자 공유를 시각적으로 보여줍니다.
* 약점 : 3D 모양이 아닌 원자의 연결만을 보여줍니다.
2. 구조 공식 :
* 표현 : 라인을 사용하여 원자 사이의 공유 결합을 나타냅니다.
* 강점 : 루이스 구조보다 더 작고, 원자의 배열을 보여줍니다.
* 약점 : 분자의 3D 모양을 나타내지 않습니다.
3. 볼 앤 스틱 모델 :
* 표현 : 스틱 (본드를 나타내는)으로 연결된 볼 (원자를 나타내는 공)을 사용합니다.
* 강점 : 분자의 3D 모양을 보여 주며 결합 각도를 시각화하는 데 좋습니다.
* 약점 : 부피가 커지고 조작하기가 어려울 수 있습니다.
4. 공간 충족 모델 :
* 표현 : 서로 닿는 다양한 크기 (원자를 나타내는)의 구의 구체를 사용합니다.
* 강점 : 분자가 차지하는 실제 부피를 보여주고 현실적인 표현을 제공합니다.
* 약점 : 개별 유대를보기가 어려우면 해석하기 어려울 수 있습니다.
5. 분자 궤도 다이어그램 :
* 표현 : 원자의 궤도를 보여주고 분자 궤도를 형성하기 위해 어떻게 결합하는지를 보여줍니다.
* 강점 : 결합의보다 상세하고 정확한 표현을 제공하며 결합 길이 및 결합 강도와 같은 특성을 설명 할 수 있습니다.
* 약점 : 화학에 대한보다 진보 된 이해가 필요합니다.
예 : 분자 메탄 (CH4) 를 살펴 보겠습니다 :
* 루이스 구조 : [ 시간
.
H -C -H
.
시간 ]
* 구조 공식 : CH4
* 볼 앤 스틱 모델 : 4 개의 수소 원자가 그것에 부착 된 중심 탄소 원자.
* 공간 충족 모델 : 더 큰 탄소 원자를 둘러싼 4 개의 수소 원자.
귀하에게 가장 적합한 모델은 전달하려는 특정 정보에 따라 다릅니다. 연결성에 대한 간단한 개요를 위해서는 Lewis 구조 또는 구조 공식으로 충분합니다. 3D 모양을 시각화하려면 볼 앤 스틱 또는 공간 충족 모델이 더 좋습니다. 결합에 대한 자세한 설명을 위해서는 분자 궤도 다이어그램이 필요합니다.