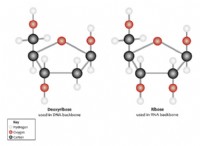
분자 (공유 화합물)
* 본딩 : 원자는 전자를 공유하여 공유 결합을 형성합니다. 이 공유는 동일하거나 (비극성), 불평등 (극) 일 수 있습니다.
* 구조 : 분자는 원자의 배열에 따라 다양한 모양과 크기를 가질 수 있습니다.
* 이름 지정 :
* 접두사 : 그리스 접두사 (mono-, di-, tri- 등)는 분자의 각 유형의 원자 수를 나타냅니다.
* 접미사 : "-ide"는 두 번째 요소에 사용되며 "-ide"는 종종 다 원자 이온의 경우 "-ate"또는 "-ite"로 변경됩니다.
이온 성 화합물
* 본딩 : 원자는 전자를 전달하여 정전기력에 의해 함께 유지되는 이온 (양이온 및 음이온)을 형성합니다.
* 구조 : 이온 성 화합물은 전형적으로 양이온 및 음이온의 반복 단위로 결정 격자를 형성합니다.
* 이름 지정 :
* 양이온 : 일반적으로 금속의 이름은 직접 사용됩니다 (예 :나트륨, 칼륨).
* 음이온 :
* 비금속 음이온은 "-ide"접미사 (예 :염화물, 황화물)를 사용합니다.
* 다 원자 음이온은 독특한 이름 (예 :황산염, 포스페이트)을 가지고 있습니다.
* 로마 숫자 : 괄호 안의 로마 숫자는 산화 상태를 나타 내기 위해 전이 금속에 사용됩니다.
이름 지정 규칙의 주요 차이
* 접두사 : 분자는 접두사를 사용하여 각 요소의 수를 나타내는 반면 이온 성 화합물은 그렇지 않습니다.
* 접미사 : 분자는 주로 두 번째 요소에 "-ide"를 사용하는 반면, 이온 성 화합물은 음이온 유형에 따라 더 넓은 접미사를 사용합니다.
* 충전 : 이온 성 화합물은 분자가하지 않는 양이온 및 음이온의 전하의 균형을 유지해야합니다.
* 로마 숫자 : 이온 성 화합물은 로마 숫자를 사용하여 전이 금속의 산화 상태를 나타내는 반면 분자는 그렇지 않습니다.
본질적으로, 다른 명명 규칙은 분자와 이온 성 화합물이 구조화되고 결합되는 다른 방식을 반영합니다. . 이러한 차이를 이해하면이 두 가지 중요한 종류의 화학 물질을 정확하게 설명하고 구별하는 데 도움이됩니다.