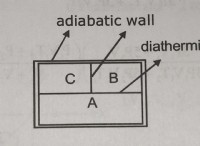
다른 반응물이 산소 (O₂)라고 가정 할 때 E-10의 연소의 균형을 맞추는 방법은 다음과 같습니다.
1. 불균형 방정식을 작성하십시오 :
```
c₂h₂oh + c₈h₁₈ + o₂ → co₂ + h₂o
```
2. 탄소 원자의 균형 :
* 에탄올에는 2 개의 탄소가 있고 옥탄에는 8 개가 있으며 왼쪽에는 총 10 개의 탄소 원자가 있습니다.
* CO₂에는 1 개의 탄소 원자가 있습니다.
* co 10 곱하기 :10 :
```
C₂H₂OH + C₈H₁₈ + O → 10co₂ + H₂O
```
3. 수소 원자의 균형 :
* 에탄올에는 6 개의 수소 원자가 있고 옥탄에는 18 개가 있으며 왼쪽에는 총 24 개의 수소 원자가 있습니다.
* HALO에는 2 개의 수소 원자가 있습니다.
* h byo를 12로 곱하십시오.
```
c ₂h₂oh + c₈h₁₈ + o₂ → 10co₂ + 12h₂o
```
4. 산소 원자의 균형 :
* 에탄올에는 1 개의 산소 원자가 있고 왼쪽에는 2 개가 있습니다.
* 10co₂에는 20 개의 산소 원자가 있고 12h ℃에는 12 개의 산소 원자가 있으며, 오른쪽에 총 32 개의 산소 원자가 있습니다.
* 균형을 잡으려면 O₂에 16을 곱하십시오.
```
C₂H₂OH + C₈H₁₈ + 16O → 10co₂ + 12H ₂O
```
5. 최종 균형 방정식 :
```
C₂H₂OH + C₈H₁₈ + 16O → 10co₂ + 12H ₂O
```
중요한 메모 :
*이 방정식은 단순화 된 E-10 혼합물의 연소를 나타냅니다. 실제 휘발유는 훨씬 더 복잡하며 E-10의 정확한 구성은 달라집니다.
*이 방정식은 연소의 주요 제품 만 보여줍니다. 실제로 오염 물질을 포함한 다른 많은 사소한 제품이 있습니다.
*이 반응은 매우 발열이므로 열과 빛의 형태로 많은 양의 에너지를 방출합니다.
E-10의 연소와 특정 유형의 휘발유의 균형을 잡으려면 해당 유형의 휘발유에 대한 화학적 공식을 알아야합니다.