다음은 고장입니다.
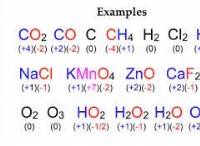
일반적으로 다중 결합을 형성하는 원자 :
* 탄소 (C) : 탄소는 다중 결합의 챔피언입니다. 단일, 이중 및 삼중 결합을 형성 할 수 있으며 많은 유기 분자의 골격입니다.
* 질소 (N) : 질소는 n 2 와 같은 분자에서 삼중 결합을 형성 할 수 있습니다 (질소 가스).
* 산소 (O) : 산소는 o 2 에서 볼 수 있듯이 이중 결합을 형성 할 수 있습니다 (산소 가스).
* 황 (s) : 황은 이중 결합을 형성 할 수 있지만 산소보다 덜 일반적입니다.
* 인 (P) : 인은 일부 화합물에서 다수의 결합을 형성 할 수 있지만 탄소, 질소 및 산소보다 덜 일반적입니다.
왜 이들 원자가 다수의 결합을 형성합니까?
* 작은 원자 반경 : 작은 반경을 가진 원자는 여러 전자 쌍을 공유 할 정도로 가까워 질 수있어 결합이 더 강해집니다.
* 높은 전기 음성 : 전기성이 높은 원자는 전자를 강력하게 끌어내어 다른 원자와 더 많은 전자를 공유 할 수 있습니다.
다중 결합에 영향을 미치는 요인 :
* 전기 음성 차이 : 두 원자 사이의 전기 음성 성의 더 큰 차이는 단일 결합을 선호합니다.
* 혼성화 : 원자 궤도의 혼성화는 다중 결합의 형상 및 가능성을 결정하는 데 역할을합니다.
* 결합 길이 : 단일 결합의 길이는 궤도의 더 큰 겹침으로 인해 이중 또는 트리플 결합의 길이보다 길다.
중요한 참고 : 이들 요소의 모든 원자가 항상 다수의 결합을 형성하는 것은 아닙니다. 결합의 유형은 특정 분자와 그 결합 환경에 따라 다릅니다.