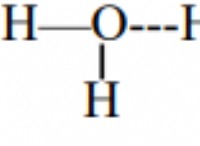개념 이해
* 몰 : 두더지는 특정 수의 입자 (원자, 분자, 이온 등)를 나타 내기 위해 화학에 사용되는 측정 단위입니다. 하나의 두더지는 Avogadro의 수 (6.022 x 10^23) 입자와 같습니다.
* 황 (s) : 황은 원소 형태의 규조토 분자 (S₂)로 존재합니다. 이것은 2 개의 황 원자가 함께 결합하여 단일 분자를 형성한다는 것을 의미한다.
계산
1. 분자에 대한 두더지 : 우리는 6.35 몰의 황을 가지고 있기 때문에 아보 가드로의 수를 사용하여 황 분자의 수를 찾을 수 있습니다.
* 6.35 몰 S * (6.022 x 10^23 분자 S / 1 몰 S) =3.82 x 10^24 분자 S
2. 황 분자 : 그러나이 숫자는 개별 황 *원자 *의 수를 나타냅니다. 유황은 S로 존재하기 때문에 황 분자의 수를 찾기 위해이 수를 2로 나누어야합니다.
* (3.82 x 10^24 분자 S) / 2 =1.91 x 10^24 분자 ST
답 : 6.35 몰의 황에 약 1.91 x 10^24 황 분자 (ST)가 있습니다.