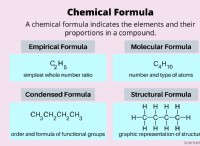
철 (II) 황산염 헵타 이드 레이트 (FESO₄ · 7H₂O)의 분해
가열 될 때, 철 (II) 황산염 헵타 이드 레이트는 일련의 분해 반응을 겪고, 궁극적으로 철 (III) 산화물 (Fe₂o₃)의 형성으로 이어진다. 다음은 프로세스의 고장입니다.
1. 탈수 :
* 처음에는 온도가 증가함에 따라 결정화의 물이 제거됩니다. 이것은 단계에서 발생하며 다른 수의 수 분자가 다른 온도에서 손실됩니다.
* 첫 번째 단계는 6 개의 물 분자의 손실을 포함하여 철 (II) 설페이트 일 수화물 (FESO₄ · HATER) 의 형성을 초래합니다. .
* 추가 가열은 남은 물 분자를 제거하여 무수 철 (II) 설페이트 (Feso₄) 를 남겨 둡니다. .
2. 산화 및 분해 :
* 고온에서, 무수 철 (II) 설페이트는 산화를 겪고 철 (III) 설페이트 (Fe₂ (So₄) ₃) 를 형성합니다. . 이 과정은 이산화황 (SO₂) 및 삼산화황 (SO₃)의 손실을 포함합니다.
* 마지막으로, 철 (III) 황산염 분해 철 (III) 산화물 (Fe₂o₃) 을 형성합니다. , 더 많은 이산화황 및 삼산화 황을 방출합니다.
전반적인 반응 :
전체 분해 반응은 다음과 같이 표현 될 수 있습니다.
```
2 FESO· · 7H₂O → FEATING
```
참고 :
* 각 단계의 분해 온도는 조건에 따라 다르지만 일반적으로 100 ° C에서 600 ° C 사이에서 발생합니다.
* 분해 과정은 복잡하며 가열 속도, 산소의 존재 및 주변의 수증기 양과 같은 요인에 의해 영향을받을 수 있습니다.
안전 예방 조치 :
* 철 (II) 설페이트 및 분해 제품에는 적절한 환기, 눈 보호 및 장갑을 포함한 적절한 안전 조치가 필요합니다.
* 이산화황과 삼중주는 독성 가스이며주의해서 다루어야합니다.
응용 프로그램 :
철 (II) 황산염 헵타 이드 레이트의 분해는 다음을 포함한 다양한 응용 분야에서 사용됩니다.
* 산화철 생산 : 안료, 도자기 및 기타 산업에 사용됩니다.
* 이산화황의 제거 : 대기 오염을 줄이기 위해 연도 가스 탈황 공정에 사용됩니다.
* 이산화황의 생산 : 황산 생산을 포함한 다양한 산업 공정에 사용됩니다.