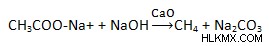화학의 주요 가지 중 하나는 유기 화학이며, 주로 공유 결합 및 탄소 원자와 유기 화합물의 구조, 특성 및 반응을 중심으로합니다.
탄화수소는 두 가지 종류의 원자, 수소 및 탄소를 구성하는 유기 화합물입니다. 이 화합물은 일반적으로 무색이며 약한 냄새가납니다. 고대 화학자들은 탄화수소를 방향족 또는 지방족으로 묘사합니다. 탄화수소를 준비 할 수있는 몇 가지 방법이 있습니다.
탄화수소는 무엇입니까?
앞에서 언급했듯이 탄화수소는 수소와 탄소라고 불리는 필수 원자로 구성된 유기 화합물입니다. 일반적으로 이들은 냄새가 거의없는 무색 가스입니다.
유형에 따라 탄화수소는 단순하거나 복잡한 구조를 가질 수 있습니다. 일상 생활에서 탄화수소는 중요한 역할을하며 그들의 연구는 기능 그룹의 특성과 준비에 대한 깊은 통찰력을 제공합니다.
탄화수소를 6 가지 범주로 나눌 수 있습니다. 여기에는 포화 탄화수소, 불포화 탄화수소, 사이클로 알칸, 방향족 탄화수소, 지방족 탄화수소 및 알리시 클릭 탄화수소가 포함됩니다.
알칸은 무엇입니까?
우리는 알칸을 단일 결합 수소와 탄소 단위를 갖는 유기 화합물로 설명 할 수 있습니다. CNH2N+2는 알칸의 공식입니다.
우리는 알칸을 사이클로 알칸, 분지 된 알칸 및 체인 알칸의 세 가지 주요 그룹으로 더 나눌 수 있습니다.
|
| 메탄 | . | ||
|
(c2h6)>. | ||||
|
| Butane |
| Pentane | (c5h12)> |
|
| (c6h14)> | |||
|
|
|
(c8h18)> | ||
|
| 데케인 | 알칸은 포화 탄화수소입니다. 이들의 탄소 원자는 시그마 결합만으로 상이한 다른 탄소 원자 세트에 가깝게 결합한다. Alkanes에서 C1에서 C4에서 시작하는 첫 4 명의 멤버는 가스이며 C5에서 C17에서 액체입니다. 대조적으로, 18 개 이상의 그 이상을 가진 사람들은 고체입니다. 그들은 색상이나 냄새가 없으며 다른 기술을 사용하여 여러 산업에서 준비됩니다. 불포화 탄화수소에서 알칸의 제조알칸을 준비하기위한 다른 방법을 살펴 보겠습니다 :- Alkenes와 Alkynes의우리는 수소화라는 과정을 사용하여 알켄과 알키의 알칸을 준비합니다. 디 하이드로 겐 가스는 알킨 및 알켄과 알칸을 형성하기 위해 팔라듐 및 니켈과 같은 촉매에 혼합된다. 니켈의 존재 하에서 반응은 증가 된 온도에서 발생합니다. 반면, 팔라듐의 경우 반응은 실온에서 발생합니다. 알킬 할라이드로부터 알칸의 제조알킬 할라이드를 통해 알칸을 준비하는 두 가지 방법이 있습니다. 그것들은 다음과 같습니다.
CH3CL +H2 (Zn, H +) → CH4 +HCl
여기에 동일한 화학 방정식이 있습니다. CH3-BR + 2NA + BRCH3 → CH3-CH3 + 2NABR. 카르 복실 산으로부터 알칸의 제조우리는 다음과 같이 두 가지 방법으로 카르복실산에서 알칸을 준비 할 수 있습니다 :
여기에 동일한 화학 방정식이 있습니다.
여기에 동일한 화학 방정식이 있습니다. 2ch3coo – na + + 2h2o → ch3 –Ch3 + 2Co2 + h2 + 2naoh. 나트륨 아세테이트 Clemmensen의 감소Clemmensen의 감소는 아연 아말감과 염산을 사용하여 케톤 또는 알데히드를 알칸으로 줄이는 데 사용되는 반응입니다. 이 반응의 이름은 덴마크 화학자 인 Erik Christian Clemmensen에서 비롯되었습니다.
결론탄화수소는 수소와 탄소라고 불리는 필수 원자로 구성된 유기 화합물입니다. 한편, 알칸은 단일 결합 수소 및 탄소 화합물을 갖고 화학적 공식 CNH2N+2를 갖는 유기 화합물이다. 또한, 우리는 알칸과 사이클로 알칸, 분지 된 알칸 및 체인 알칸을 나눌 수 있습니다. 여기서 우리는 탄화수소 - 알칸의 준비에 대해 논의했습니다. 우리는 수소화를 통해 Alkene과 Alkyne에서 알칸을 준비 할 수 있습니다. 알킬 할라이드를 통해 알칸을 준비하는 두 가지 방법이 있습니다. 첫째, 희석 된 염산 및 아연으로 감소를 통해. 다른 하나는 Wurtz 반응이라고합니다. 우리는 또한 카르 복실 산으로부터의 알칸의 제조에 대해 논의하고 Clemmensen의 감소를 간단히 설명했다. . |