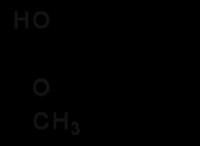
1. 산성 배지 제공 :
* 반응 조건 : 철 이온 (Fe²⁺)과 디 히메이트 이온 (crateo₇²⁻) 사이의 반응은 산성 배지에서 효율적으로 진행된다.
* 산의 역할 : 농축 황산 (HASSOA)은 필요한 산도를 제공합니다.
2. 원치 않는 제품의 형성 방지 :
* Fe²⁺의 산화 : 산소의 존재하에, 철 이온 (Fe²⁺)은 디 히 트로 메이트가 없어도 제 2 철 이온 (Fe³⁺)으로 산화 될 수있다.
* hoso>는 이것을 방지합니다 : 황산에 의해 생성 된 강한 산성 환경은 이러한 원치 않는 산화를 억제합니다.
3. 디크로 메이트 감소 촉진 :
* 산화제로서의 디크로 메이트 : 디크로 메이트는이 적정에서 산화제 역할을한다.
* 산의 역할 : 산성 배지는 크롬 (III) 이온 (CR³⁺)으로 디크로 메이트 이온 (cr₂o₇²⁻)의 감소를 촉진시켜 반응을보다 완전하게한다.
4. 간섭 방지 :
* 다른 산화제 : 일부 불순물은 적정을 방해하여 산화제 역할을 할 수 있습니다. 산성 환경은 이러한 간섭을 최소화하는 데 도움이됩니다.
요약 : 농축 황산은 산성 배지를 제공하고, 원치 않는 산화를 방지하고,이 히메이트 이온의 감소를 촉진하여, 정확하고 신뢰할 수있는 결과를 초래함으로써, 디 히 트로 메이트에 대한 Mohr의 소금의 적정에 중요한 역할을한다.