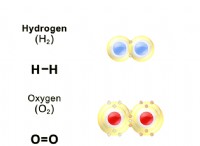
* 물 (h>o) 분자는 polar 입니다 - 약간 양수 끝 (수소)과 약간 음의 끝 (산소)이 있습니다. 이 극성은 강한 수소 결합으로 이어진다 물 분자 사이. 이러한 결합은 상대적으로 강하고 파손하기 위해 상당한 에너지가 필요하며, 물 분자는 실온에서도 밀접하게 연관되어 있습니다.
* 산소 (O₂) 분자는 비극성이다 . 그들은 전자의 균일 한 분포를 가지고있어 런던 분산 세력이 매우 약해집니다 . 분자 사이. 이 힘은 수소 결합보다 훨씬 약하므로 산소 분자가 자유롭게 이동하기가 더 쉬워 실온에서 기체 상태가됩니다.
여기 단순화 된 비유가 있습니다 :
산소 분자는 거의 서로 붙어있는 작은 구슬과 같지만 물 분자가 서로를 강하게 끌어들이는 작은 자석으로 상상해보십시오. 물 분자 사이의 강한 인력은 그것들을 가까이하게 유지하여 액체를 만들고 산소 분자 사이의 약한 인력은 자유롭게 날아갈 수있게하여 가스를 만듭니다.
요약 :
* 물의 강한 수소 결합 실온에서 액체를 유지하십시오.
* 산소의 약한 런던 분산 힘 실온에서 가스가되도록하십시오.