핵심 개념 :
이 튜토리얼에서는 옥넷 규칙이 무엇인지, 규칙에 대한 예외를 배우고 예와 문제를 참조합니다.
옥트 규칙은 무엇입니까?
옥트 규칙은 원자가 쉘의 8 개의 전자로 둘러싸여있을 때 원자가 가장 안정적이라는 것입니다. 8 개의 전자가없는 원자는 다른 원자와 결합하여 8 개의 전자를 갖습니다. 8 개의 전자가있는 구성은 '고귀한 가스 구성'이라고도합니다.
고귀한 가스는 8 개의 원자가 전자가있는 유일한 원자이므로 다른 원자 및 분자와 반응하거나 결합하지 않는 경향이 있습니다. 이러한 반응 부족은 이미 전자의 전체 덩어리가있는 가장 안정적인 상태에 있기 때문입니다. 따라서 옥틴 전체가있는 다른 원자가 'Noble-Gas 구성'에서 언급되는 이유
채워진 원자가 옥트는 S와 P- 궤도가 채워 졌음을 의미합니다. 따라서 전자 구성은 s 로 끝납니다 p 전체 옥셋이있는 모든 원자에 대해.
옥트 규칙 달성
옥트 규칙은 이온 또는 공유 결합을 통해 얻을 수 있습니다. 공유 결합에서, 원자는 전자를 공유한다. 이온 결합에서, 원자는 전자를 서로 사이로 전달한다.
일반적으로 금속은 8 개의 전자의 원자가 껍질을 달성하기 위해 전자를 잃게됩니다. 비금속은 8 개의 전자를 얻기 위해 전자를 얻는 경향이 있습니다.
특정 원자는 옥트 규칙을 충족시키기 위해 특정 수의 결합을 갖는 경향이 있습니다. 예를 들어, 탄소는 거의 항상 4 개의 결합을 가질 것입니다. 질소에는 거의 항상 3 개의 결합과 고독한 쌍이 있습니다. 산소에는 일반적으로 두 개의 결합이 있습니다. 불소에는 일반적으로 하나가 있습니다. 트렌드를 알아야합니다. 주기율표의 행을 가로 질러 이동함에 따라 채권의 수는 공유 결합 인 요소 (비 메탈)에 대해 감소하는 경향이 있습니다.
채권 수를 감소시키는 이러한 경향은 위에서 논의한 것보다 낮은 행에 적용됩니다. 주기 테이블에서 더 아래로 움직일수록 옥트 규칙에 대한 예외가 있습니다.
옥트 규칙에 대한 예외
- 전이 금속은 일반적으로 옥트 규칙을 따르지 않습니다. 대신, D- 블록 전자 때문에 원자가 쉘에 더 많은 전자를 가질 수 있습니다.
- 헬륨과 수소는 모두 옥트 규칙을 따르지 않고 대신 원자가 쉘에 2 개의 전자가 안정되도록합니다. 이것은 p- 궤도가없고 s 가 필요하기 때문입니다. 궤도가 채워졌습니다.
- 리튬은 종종 헬륨 (2 개의 전자)과 동일한 구성을 갖도록 전자를 잃게됩니다.
- 일부 화합물은 옥트 규칙에 불순종합니다. 예를 들어, sf 6 및 xef 2 실험실에서 일반적으로 만들어진 가스가 있습니다. 원자가 주기성 테이블에 더 낮을수록, 원자가 쉘에 8 개의 전자가없고 여전히 안정적 일 가능성이 높습니다. .
예제 문제
다음은 원자가 옥트 규칙을 따르는 지 여부를 결정하기 위해 전자를 세는 방법을 설명하는 몇 가지 예입니다. 분자는 Lewis Dot 구조를 사용하여 그려집니다.
n 2 - 질소

질소 원자 사이에는 3 개의 공유 결합이 있으며 각 질소에는 고독한 쌍이 있습니다. 따라서 각 질소 원자와 관련된 총 전자 수는 8이고 두 원자는 규칙을 따릅니다.
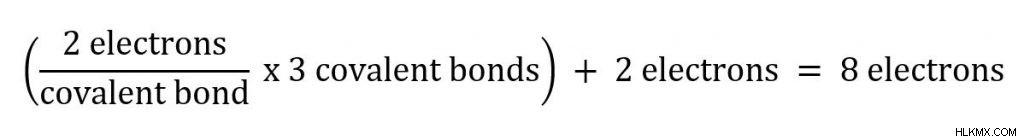
ch 4 - 메탄

메탄 (ch 4 에서 ) 볼 수있는 두 가지 원자가 있습니다. 우리는 4 개의 공유 결합이있는 탄소로 시작할 것입니다. 각 공유 결합과 관련된 두 개의 전자가 있으므로 탄소는 옥트 규칙을 따릅니다.
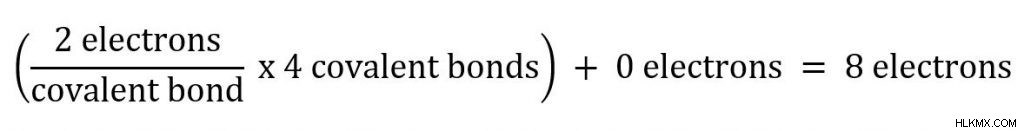
ch 4 의 수소 모두 그들과 관련된 하나의 공유 결합을 가지고 있으며, 그것들은 총 전자 2 개를 제공합니다. 수소는 규칙에 대한 예외이며 두 개의 전자에서 안정적이라는 것을 기억하십시오!
예제 문제
문제 : Octet Rule에 대해 알고있는 것을 사용하여 HCN의 구조를 그립니다.
솔루션 : 탄소와 질소는 모두 옥트 규칙을 따르고 수소에는 두 개의 전자가 있습니다. 우리는 함께 일할 총 10 개의 전자가 있습니다. 시작하기에 좋은 곳은 질소에 탄소에 세 가지 결합을주는 것입니다. 그런 다음 탄소는 하나의 결합이 필요하며, 이는 하나의 결합 수소 요구에 맞습니다. 구조가 해결되었습니다!

문제 : 옥트 규칙에 대해 알고있는 것을 사용하여 ch 2 의 구조를 그립니다. o
솔루션 : 처음에는 탄소에 4 개의 결합이 있고 산소가 2 개, 수소가 1 개를 가질 것이라는 정보에 근거한 예측을 할 것입니다. 모든 원자가 전자를 계산하면 12 개의 전자가 함께 사용할 수 있습니다. 아마도 탄소는 가장 많은 채권이 필요하기 때문에 중심 원자가 될 가능성이 높습니다. 거기에서 이중 결합으로 산소에 연결할 수 있습니다. 산소는 이제 옥켓 규칙을 만족시키기 위해 두 개의 고독한 쌍이 필요합니다. 탄소는 각 수소에 하나씩 두 개의 결합이 필요합니다. 우리는 우리 구조의 모든 전자를 세고 12 개의 전자를 가지고 있음을 알 수 있으며 모든 원자는 옥트 규칙을 만족시킵니다 (수소의 예외).
.